MDT 577.1:616.89
ENDOGÉNY ETANOL A ACETALDEHYD,
ICH BIOMEDICÍNSKÝ VÝZNAM (Prehľad literatúry)
Yu. A. Tarasov, Ph.D. sci., vedúci výskumník; V. V. Lelevich, doktor lekárskych vied, profesor
Vzdelávacie zariadenie "Štátna lekárska univerzita Grodno"
Prehľad uvádza literárne údaje o metabolizme endogénneho etanolu a acetaldehydu v organizme, ako aj o ich biologickom význame.
Kľúčové slová: endogénny etanol, acetaldehyd, alkoholdehydrogenáza, aldehyddehydrogenáza, pyruvátdehydrogenáza.
Prehľad uvádza literárne údaje o metabolizme endogénneho etanolu a acetaldehydu v organizme, ako aj o ich biologickej hodnote.
Kľúčové slová: endogénny etanol, acetaldehyd, alkoholdehydrogenáza, acetaldehyddehydrogenáza, pyruvátdehydrogenáza.
Pri charakterizácii biologickej aktivity etanolu a jeho metabolitu acetaldehydu by sa mali zdôrazniť dva aspekty problému. Po prvé, pokiaľ ide o tieto zlúčeniny, ako prirodzené metabolity, neustále (endogénne) prítomné v tele vo fyziologických koncentráciách. Po druhé, keď nastane situácia s exogénnym príjmom alkoholu do organizmu, teda vznik stavov akútnej alebo chronickej intoxikácie alkoholom.
Etanol a jeho metabolity sú prirodzené zložky metabolizmu a sú nepostrádateľnými účastníkmi homeostatických mechanizmov. Na posúdenie metabolického významu endogénneho etanolu je potrebné porovnať jeho hladinu v krvi a tkanivách s obsahom známych substrátov – účastníkov metabolizmu u ľudí a zvierat (pozri tabuľku). To umožňuje zabezpečiť, že s prihliadnutím na relatívne malú molekulovú hmotnosť etanolu sa dá ľahko postaviť na rovnakú úroveň s medziproduktmi metabolizmu sacharidov a bielkovín. Z údajov uvedených v tabuľke vyplýva, že v tejto sérii je koncentrácia neurotransmiteru o niekoľko rádov nižšia ako u endogénneho etanolu. Ale obsah acetaldehydu, ktorý je v tele neustále prítomný v rovnovážnom pomere (1:100) s etanolom, je s ním celkom porovnateľný. To naznačuje, že úloha páru etanol/acetaldehyd pri udržiavaní homeostatických metabolických funkcií je podobná úlohe, ktorú v tele vykonávajú pomery glukóza/glukóza-6-fosfát a laktát/pyruvát pri kontrole glykolýznych reakcií a stabilizácii hladín medziproduktov glykolýzy.
Množstvo pyruvátu v tkanivách je o 2-3 rády nižšie ako množstvo laktátu, ale samotný pyruvát, podobne ako acetaldehyd, je vysoko reaktívny. Pri meniacich sa metabolických situáciách sa hladiny pyruvátu výrazne posúvajú
Zložená krv (mol/l) Pečeň (mol/kg)
Glukóza 5-10-3
Glukóza-6-fosfát 2 ■ 10- 4
Fruktóza-6-fosfát 2■10-4
Fosfodioxyacetón 10-5-10-4 10-4
Aminokyseliny 10-4 - 10-3
Etanol 10-4 10-4
Adrenalín 10-9
v menšej miere ako hladina laktátu, čo nepochybne odráža väčší význam v metabolizme prvej, a nie druhej zlúčeniny. Preto sa laktát považuje za tlmiacu metabolickú slepú uličku, ktorá vyrovnáva výkyvy v pyruváte. Z rovnakého hľadiska je systém etanol/acetaldehyd podobným kontrolným bodom pre dvojuhlíkové zlúčeniny a samotný acetaldehyd. Toto hodnotenie vzťahu etanol/acetaldehyd celkom uspokojivo vysvetľuje labilitu endogénnej hladiny etanolu pri rôznych expozíciách. Endogénny etanol teda hrá úlohu tlmivého roztoku, ktorý je v rovnovážnom dynamickom vzťahu s jeho veľmi aktívnym prekurzorom, acetaldehydom. Uvažovaný pár β-etanol/acetaldehyd (pozri obrázok) vykonáva podobné funkcie zásobníka pufrov s ohľadom na veľmi aktívny metabolit α-acetaldehyd, najmä s ohľadom na neurohormóny. Etanol funguje v tomto systéme ako vyrovnávacia rezerva pre acetaldehyd, vyrovnáva výkyvy, ktoré nevyhnutne vznikajú v dôsledku sínusového charakteru toku viacčlánkových reťazových reakcií v metabolizme.
Sacharidy, lipidy, aminokyseliny
Laktát □ pyruvát □ acetyl-CoA
Etanol □ acetaldehyd □ acetát
Iné zdroje
Obrázok - Laktát a etanol ako metabolické "slepé uličky" pri výmene pyruvátu a acetaldehydu
Heterogenita funkcií endogénneho etanolu, ktorý môže byť veľmi odlišný - zdroj energie, prekurzor acetaldehydu, ktorý sa podieľa na syntéze endogénnych zlúčenín podobných morfínu a ktorý je najsilnejším modifikátorom amínových a sulfhydrylových skupín v proteínoch . Acetaldehyd ako najsilnejší modifikátor proteínov mení nielen ich reaktivitu, ale aj priestorové charakteristiky, teda parametre, ktoré sú najdôležitejšie pre efektívnu väzbu neurotransmiterov na receptorové proteíny. Amfifilná povaha etanolu a acetaldehydu hrá významnú úlohu pri udržiavaní určitej hydrofóbnosti proteínov a ich potrebnej funkčnej tekutosti.
Obe zlúčeniny sa považujú za dvojuhlíkové radikály schopné kompetitívne interagovať s mnohými ďalšími dvojuhlíkovými molekulami na úrovni aktívnych miest enzýmov, transportných proteínov a špecifických receptorov. Membranotropizmus etanolu je funkčne dôležitý v patogenéze prejavov alkoholického ochorenia, pretože rôzne dioly, ktoré navyše netvoria acetaldehyd, môžu zmierniť prejavy abstinenčného syndrómu etanolu. Pár etanol/acetaldehyd môže byť obzvlášť dôležitý vo vzťahoch s neurotransmitermi obsahujúcimi hydroxylové alebo karbonylové skupiny, hormóny, ich prekurzory a metabolity, pretože koncentrácia týchto bioregulátorov je výrazne nižšia ako koncentrácia endogénneho etanolu a acetaldehydu.
Množstvo endogénne vytvoreného a metabolizovaného acetaldehydu a etanolu je preto potrebné považovať za faktor, ktorý riadi významnú časť homeostatických mechanizmov, ktoré v konečnom dôsledku formujú stav, o ktorý sa každý organizmus vždy usiluje – „metabolický komfort“.
Opakovane opakované v rôznych sezónnych obdobiach roka, výber zvierat vo vzťahu ku spotrebe etanolových roztokov vždy umožnil izolovať od bežnej populácie potkanov, ktoré preferujú vodu (W) alebo etanol (E). PE tvorila približne 5-10 % všetkých testovaných zvierat. Charakteristickým znakom jedincov s PE bolo, že obsah endogénneho etanolu v krvi a najmä v pečeni bol vždy 2-3 krát nižší ako u PV. Na druhej strane, zistené inverzné korelačné vzťahy medzi úrovňou endogénneho etanolu a dobrovoľnou konzumáciou alkoholu v podstate opakujú patogenetickú situáciu: hodnota endogénneho etanolu a acetaldehydu je taká, že keď sú v tele nedostatočné, ďalší príjem alkoholu sa stáva najjednoduchším spôsobom sebakorekcia. Extrapolácia týchto vzťahov na mechanizmy patogenézy alkoholizmu zase umožňuje domnievať sa, že dlhotrvajúca nadmerná konzumácia alkoholu, vynútená pri pokusoch na zvieratách a dobrovoľne alebo sociálne motivovaná u ľudí, prípadne nahrádzajúca produkciu endogénneho etanolu a acetaldehydu, najprv vedie k inhibícii a potom k degradácii systémov endogénnej syntézy týchto zlúčenín. Teda do situácie, kedy sa vonkajší príjem alkoholu do tela stáva nevyhnutným. Do značnej miery, prirodzene, zjednodušene, bez zohľadnenia faktora drogovej závislosti v patogenéze, takéto vzťahy môžu vysvetliť fenomén fyzickej závislosti, ako aj pochopenie toho, prečo je v delirantných stavoch najlepší a najjednoduchší spôsob, ako ich zastaviť. je zaviesť pacientovi alkohol.
Vzťah medzi motiváciou alkoholu a hladinou endogénneho etanolu možno vysledovať aj v iných experimentálnych situáciách. Rôzne faktory ovplyvňujúce konzumáciu alkoholu zvieratami alebo liečivami používanými na liečbu sa teda podľa vplyvu na hladinu endogénneho etanolu v krvi a pečeni rozdelili do dvoch diametrálne odlišných skupín. Všetky účinky, ktoré zvyšujú motiváciu alkoholu, ako sú: stres, hladovanie, oxytiamín, iproniazid, tetrahydroizochinolíny - znižujú a oslabujú motiváciu alkoholu (tiamín, tiamíndifosfát, riboflavín, dietylditiokarbamát, glutamín, chlorid lítny) -
zvýšiť hladinu endogénneho etanolu. Tieto údaje dopĺňajú štúdie iných autorov vo vzťahu k trankvilizérom, kastrácii a experimentom, pri ktorých sa potkany rôzne citlivé na narkotický účinok etanolu líšili aj v hladine endogénneho etanolu. Stanovenie hladiny endogénneho etanolu sa používa na narkologických klinikách v Poľsku na dynamickú kontrolu aplikovanej terapeutickej liečby pacientov s alkoholickým ochorením. V klinike pre liečbu závislosti od alkoholu Petrohradského psychoneurologického inštitútu. V. M. Bekhterev úspešne použil metódu na liečbu alkoholizmu, založenú na obnove homeostázy endogénneho etanolu v tele pacientov.
Je potrebné poznamenať, že uvedené varianty prejavu aktivity etanolu a acetaldehydu sú dôležité nielen pri akútnej a chronickej intoxikácii alkoholom, ale, čo je najdôležitejšie, v prírodných podmienkach, pri endogénnom fungovaní zlúčenín. Zároveň sa pri hodnotení biologickej aktivity etanolu rozlišujú dve možnosti: metabolická a toxikologická. V prvom prípade je na čele endogénny etanol – ako prirodzený metabolit metabolizmu. V druhom prípade etanol, ktorý vstupuje do tela v nadbytku, pôsobí ako silné toxikologické činidlo a faktor metabolického rozkladu metabolizmu. V jednom aj v druhom prípade fungujú prakticky rovnaké systémy, ktoré metabolizujú alkohol a aldehyd, a do procesov metabolizmu týchto zlúčenín sú zahrnuté všetky hlavné systémy tela. Alkohol vstupujúci do tela sa v pečeni oxiduje o 75-95%. Ostatné orgány majú oveľa nižšiu schopnosť metabolizovať etanol. Okrem toho sa malé množstvá vylučujú z tela močom a vydychovaným vzduchom.
Hlavné systémy metabolizujúce alkohol:
Alkoholdehydrogenáza (ADH, EC 1.1.1.1) je enzým široko distribuovaný v živočíšnych tkanivách a rastlinách. ADH katalyzuje reverzibilnú konverziu alkoholov na zodpovedajúce aldehydy a ketóny s NAD ako kofaktorom:
Alkohol + NAD □ aldehyd + NADH + H+
Treba zdôrazniť, že pri fyziologickom pH prebieha redukcia aldehydov alebo ketónov desaťkrát rýchlejšie ako oxidácia alkoholov. Iba pri mnohonásobnom (100-1000-násobnom) zvýšení koncentrácie etanolu, ako sa to stáva pri zaťažení tela alkoholom, funguje enzým v opačnom smere. Ako substráty pre ADH slúžia primárne a sekundárne alifatické alkoholy a aldehydy, retinol, iné polyénové alkoholy, dioly, pantotenylalkohol, steroidy, □-hydroxy mastné kyseliny, 5-hydroxyetyltiazol a iné. Okrem toho je potrebné poznamenať, že etanol a acetaldehyd nie sú najlepšími substrátmi pre ADH. Štúdia intracelulárnej distribúcie ADH v pečeni ukázala, že enzým je lokalizovaný v cytosóle hepatocytov, ale nie v Kupfferových bunkách. Veľký funkčný význam ADH potvrdzujú zmeny aktivity enzýmu v orgánoch a tkanivách za rôznych patologických stavov. Prirodzenou funkciou ADH, prítomnej v obrovských množstvách v pečeni ľudí a zvierat, je to, že enzým endogénny etanol skôr produkuje ako nespotrebováva, a tak aktívne reguluje jeho hladiny a udržiava endogénnu homeostázu acetaldehydu.
Mikrozomálny etanol-oxidačný systém (MEOS). Oxidácia etanolu mikrozómami prebieha podľa nasledujúcej rovnice:
С2Н5ОН + NAPH + Н+ + О 2 □ CH 3СНО + NADP+ + 2Н О Optimálne pH tejto reakcie leží vo fyziologickej oblasti, KM pre etanol je 7-10 Mm, čo je oveľa viac ako pre ADH. MEOS sa líši od ADH a katalázy citlivosťou na inhibítory, ako aj množstvom ďalších vlastností. Je necitlivý na pôsobenie pyrazolu a azidu sodného. MEOS je aktivovaný propyltiouracilom a hormónmi štítnej žľazy. Predpokladá sa, že MEOS je identický s nešpecifickými oxidázami, ktoré detoxikujú liečivá v pečeni, a že práve cez MEOS prechádza ADH-nezávislá dráha oxidácie etanolu v tele cicavcov. MEOS, so všetkými dôkazmi, funguje nezávisle od ADH a katalázy a jeho príspevok k oxidácii etanolu je normálne asi 10 %, ale výrazne sa zvyšuje pri intoxikácii alkoholom.
Kataláza (EC 1.11.1.6) v prítomnosti peroxidu vodíka je schopná oxidovať etanol na acetaldehyd podľa rovnice:
C COH + CO2 □ CH3CHO + 2H2O Enzým funguje v širokom spektre živočíšnych tkanív a má druhové aj individuálne výkyvy vo svojej aktivite. Zdrojmi peroxidu vodíka sú reakcie katalyzované glukózooxidázou, xantínoxidázou, NADPH oxidázou. Maximálna aktivita katalázy nastáva pri fyziologickom pH. Rýchlosť katalázovej reakcie závisí od koncentrácie etanolu a rýchlosti tvorby peroxidu vodíka. Telo má značné množstvo systémov, ktoré generujú peroxid vodíka a sú lokalizované v peroxizómoch, endoplazmatickom retikule, mitochondriách, cytosóle a vytvárajú koncentráciu peroxidu vodíka v rozmedzí 10-8 - 10-6M. Podobne ako MEOS je katalázová dráha oxidácie etanolu klasifikovaná ako vedľajšia, ktorá nadobúda určitý význam až pri vysokých koncentráciách etanolu v organizme alebo v podmienkach inhibície ADH.
Ukázala sa možnosť oxidácie etanolu prenosom jeho molekuly na □-hydroxyetylový radikál, ku ktorému môže dôjsť pri prenose elektrónov syntázou oxidu dusnatého, ktorá je schopná vytvárať superoxidový radikál, ako aj peroxid vodíka. Výskumníci vyjadrujú názor, že syntáza oxidu dusnatého z hľadiska úrovne oxidácie etanolu nie je menej významná ako cytochróm P-450 za predpokladu, že ako hlavný substrát je prítomný L-arginín.
Jedným zo zdrojov endogénneho etanolu v tele zvierat je črevná mikroflóra. Pri pokusoch na angiostomizovaných zvieratách sa súčasným odberom krvi z portálnej žily a periférneho žilového riečiska ukázalo, že krv prúdiaca z čreva obsahuje viac etanolu ako krv prúdiaca z pečene.
Pri hodnotení bilančných vzťahov pri výmene etanolu je preto potrebné brať do úvahy jeho dva zdroje a hlavnú, rozhodujúcu úlohu pečeňovej alkohol-zlatodehydrogenázy v regulácii úrovne alkoholémie.
Oxidácia aldehydov v tele cicavcov prebieha najmä nešpecifickou aldehyddehydrogenázou (AlDH, K.F.1.2.1.3). Reakcia katalyzovaná enzýmom je nevratná:
CH3CHO + NAD+ + H2O □ CH 3COOH + NADH + 2H+
Pečeňové aldehyddehydrogenázy sú reprezentované dvoma enzýmami: s nízkou (vysoká Km) a vysokou (nízka Km) afinitou k acetaldehydu, výhodne s použitím alifatických substrátov a NAD ako koenzýmu alebo aromatických aldehydov a NADP ako koenzýmu. AlDH existuje vo viacerých molekulárnych formách, ktoré sa líšia štruktúrou, katalytickými charakteristikami a subcelulárnou lokalizáciou. U cicavcov sú izoenzýmy AlDH klasifikované do piatich rôznych tried. Každá trieda má špecifickú bunkovú lokalizáciu, ktorá prevláda u rôznych druhov, čo naznačuje veľmi skorú divergenciu vo vývoji AlDH. Okrem dehydrogenázy má pečeňový AlDH esterázovú aktivitu. Aktivita AlDH bola nájdená v mitochondriách, mikrozómoch a cytosóle.
Známe, ale menej prebádané, sú ďalšie enzýmy podieľajúce sa na premene acetaldehydu, ako sú: aldehydreduktáza, aldehydoxidáza a xantínoxidáza. Ale, ako je uvedené vyššie, redukciu acetaldehydu v tele vykonáva hlavne AlDH a zatiaľ sa acetaldehyd považuje za jediný známy prekurzor endogénneho etanolu.
V prípade živočíšnych tkanív je známe, že na produkcii acetaldehydu sa podieľajú nasledujúce enzýmy:
Pyruvátdehydrogenáza (EC 1.2.4.1) zvyčajne katalyzuje oxidačnú dekarboxyláciu pyruvátu na acetyl-CoA. Zároveň je dekarboxylačná zložka tohto polyenzymatického komplexu schopná uvoľňovať voľný acetaldehyd počas reakcie. Ten sa buď oxiduje AlDH v mitochondriách na acetát, alebo sa ADH redukuje na etanol v cytoplazme.
O-fosforyletanolamínfosfoliáza (EC 4.2.99.7)
Enzým, ktorý rozkladá fosfoetanolamín na acetaldehyd, amoniak a anorganický fosfát.
Treoninaldoláza (K.F.4.1.2.5) - katalyzuje reakciu štiepenia treonínu na glycín a acetaldehyd.
Aldoláza (EC 4.1.2.7) živočíšnych tkanív má špecifickosť len vo väzbe dihydroxyacetónfosfátu a ako druhý substrát využíva akékoľvek aldehydy. Pri reverznej reakcii zase týmto spôsobom vzniká acetaldehyd.
Nedávno sa ukázalo, že proti poklesu koncentrácie acetaldehydu v živočíšnych tkanivách za podmienok selektívnej inhibície aktivity pyruvátdehydrogenázy môže pôsobiť inverzná povaha zmien v aktivite fosfoetanolamínlyázy a treonaldolázy.
Je tiež známe, že pri rozklade □-alanínu, produktu degradácie pyrimidínových dusíkatých zásad, vzniká najskôr malónový aldehyd a potom acetaldehyd.
Na záver analýzy údajov z literatúry je potrebné poznamenať, že endogénny etanol je neustále prítomný v ľudských a zvieracích organizmoch v koncentráciách porovnateľných s hladinami iných prírodných medziproduktov.
metabolické rozsievky. Hladina endogénneho etanolu v krvi a tkanivách je modulovaná rôznymi zlúčeninami (hormóny, vitamíny, antimetabolity, aminokyseliny a ich deriváty, lítiové soli, disulfiram, kyánamid) a zmenami pri rôznych funkčných stavoch organizmu (stres, hladovanie, starnutie). ), ktorého mechanizmus účinku je zjavne heterogénny. Samotná rovnováha v endogénnom systéme etanol/acetaldehyd, poskytovaná ADH a inými enzýmami, ktoré produkujú a spotrebúvajú acetaldehyd, samozrejme riadi výmenu dvoch uhlíkov, ako aj syntézu zlúčenín podobných morfínu, reguluje aktivitu niektorých neurotransmiterov, peptidov a bielkoviny. Na druhej strane, zmeny v aktivite systémov metabolizujúcich alkohol a aldehyd, ako za ich fyziologických podmienok, tak aj za podmienok zmenených alkoholovou záťažou, sú v podstate adaptívne a poskytujú vhodnú funkčnú a metabolickú homeostázu.
Recenzia je venovaná blaženej pamiatke učiteľa, akademika Jurija Michajloviča Ostrovského, ktorý významnou mierou prispel k pochopeniu mechanizmov regulácie metabolizmu endogénneho etanolu a acetaldehydu, ich biomedicínskeho významu a biochémie vývoja alkoholických chorôb.
Literatúra
1. Andrianová, L.E. Neutralizácia toxických látok v tele / L.E. Andria nova, S.N. Siluyanov a // Biochemistry - 5th ed.; vyd. E.S. Severina - M.: GEOTAR-Media, 2009. - S. 619-623.
2. Andronová, L.I. Vlastnosti autostimulácie a endogénneho etanolu u potkanov rôznych pohlaví / L.I. Andronova, R.V. Kudryavtsev, M.A. Konštantínopol, A.V. Stanishevskaya // Bull. odborník biol. a med. - 1984. - T. 97, č. 6. - S. 688-690.
3. Burov, Yu.V. N neurochémia a farmakológia alkoholizmu / Yu.V. Burov, N.N. Vederniková - M.: Medicína, 1985. - 238. roky.
4. Závodník, I.B. Štúdium interakcie acetaldehydu s proteínmi a biologicky aktívnymi zlúčeninami / I.B. Závodník, N.S. Semukha, I.I. Stepuro, V.Yu. Ostrovsky // Biochémia alkoholizmu; vyd. Yu.M. Ostrovského. - Minsk: Veda a technika, 1980.- S. 68.
5. Lakoza, G.N. Hladina endogénneho etanolu a poruchy systémov závislých od testosterónu pri experimentálnom alkoholizme samcov bielych potkanov / GN. Lakoza, N.V. Tyurina, R.V. Kudryavtsev, N.K. Barkov // I Moskva. vedecké a praktické. konferencia psychiatrov-on-kológov / Problematika patogenézy, kliník a liečby alkoholických ochorení. - M., 1984.- S. 66-68.
6. Lakoza, G.N. O význame centrálnej regulácie sexuálneho správania pri experimentálnom alkoholizme u samcov bielych potkanov
/ GN. Lakoza, A.V. Kotov, A.F. Meshcheryakov, N.K. Barkov // Pharma-Col. a toxikol. - 1985. - V. 4, č. 3. - S. 95-98.
7. Lelevich, V.V. Stav zásoby voľných aminokyselín v krvi a pečeni pri chronickej intoxikácii alkoholom / V.V. Lele-vich, O.V. Artemova // Časopis Štátnej lekárskej univerzity v Grodne. - 2010. - č. 2. - S. 16-19.
8. Ostrovskij, Yu.M. Metabolický koncept genézy alkoholizmu / Yu.M. Ostrovského // Etanol a metabolizmus; vyd. Yu.M. Ostrovskij - Minsk: Veda a technika, 1982. - S. 6-41.
9. Ostrovskij, Yu.M. Hladina endogénneho etanolu a jeho súvislosť s dobrovoľnou konzumáciou alkoholu potkanmi / Yu.M. Ostrovský, M.N. Sadovník, A.A. Bankovský, V.P. Obidin // Správy Akadémie vied BSSR. - 1983. - T. 27, č. 3. - S. 272-275.
10. Ostrovskij, Yu.M. Spôsoby metabolizmu etanolu a ich úloha pri rozvoji alkoholizmu / Yu.M. Ostrovský, M.N. Záhradník // Výsledky vedy a techniky. Toxikológia. - M.: VINITI, 1984. - Vydanie. 13. - S. 93-150.
11. Ostrovskij, Yu.M. Biologická zložka v genéze alkoholizmu / Yu.M. Ostrovský, M.N. Záhradník, V.I. Satanovská; vyd. Yu.M. Ostrovskij - Minsk: Veda a technika, 1986.
12. Ostrovskij, Yu.M. Metabolické predpoklady a dôsledky konzumácie alkoholu / Yu.M. Ostrovský, V.I. Satanovská, S.Yu. Ostrovský, M.I. Selevič, V.V. Lelevich; vyd. Yu.M. Ostrovskij - Minsk: Veda a technika, 1988. - 263 s.
13. Pyzhik, T.N. Cesty syntézy acetaldehydu za podmienok selektívnej inhibície pyruvátdehydrogenázy oxytiamínom
/ T.N. Pyzhik // Journal of Grodno State Medical University. - 2010. - č. 3. - S. 87-88.
14. Solodunov, A.A. Skúmanie účinku alkoholov na väzbu ligandov sérovým albumínom / A.A. Solodunov, T.P. Gaiko, A.N. Artsukevich // Biochémia alkoholizmu; vyd. Yu.M. Ostrovského. - Minsk: Veda a technika, 1980. - S. 132.
15. Blomstand, R. Pozorovanie tvorby etanolu v črevnom trakte u človeka / R. Blomstand // Life Sci. - 1971. - Sv. 10. - S. 575-582.
16. Chin, J.H. Zvýšený obsah cholesterolu v erytrocytoch a mozgových membránach u etanol-tolerantných myší / J.H. Chin, L.M. Parsons, D.B. Goldstein // Biochim. Biophys. acta. - 1978. - Sv. 513.-P 358-363.
17 Collins, M.A. Tetraizochinolíny in vivo. Tvorba salsolinolu v mozgu potkana, produktu dopamínu a acetaldehydu za určitých podmienok počas intoxikácie etanolom / M.A. Collins, M.G. Bigdell /
/ Life Sci. - 1975. - Sv. 16.-P 585-602.
18. Higgins, J.J. Biochémia a farmakológia etanolu / J.J. Higgins // New Jork-London, 1979. - P 531-539.
19. Kopczynsk a , T. T the influence of a lcohol dependence on oxidative stress para metrov / T. Kopczynsk a , L. Torlinski, M. Ziolkowski // Postepy Hig. Med. Dosw. - 2001. - Zv. 55, č. 1. - P 95-111.
dvadsať . Lu k a szewicz, A. T porovnanie koncentrácie endogénneho etanolového krvného séra u alkoholikov a u nealkoholikov v rôznych štádiách abstinencie / A. Lukaszewicz, T. Markowski, D. Pawlak // Psychiatr. Paul - 1997. - Zv. 31, - P 183-187.
21. Nikolaenko, V.N. Udržiavanie homeostázy endogénneho etanolu ako metóda liečby alkoholizmu / V.N. Nikolaenko // Býk. Exp. Biol. Med. - 2001. - Zv. 131,
č. 3. - str. 231-233.
2 2 . O strovski, Yu .M. Endogénny etanol – jeho metabolický, behaviorálny a biomedicínsky význam / Yu.M. Ostrovský // Alkohol.
1986. - Vol. 3. - S. 239-247.
23. Porasuphatana, S. Inducibilná syntetáza oxidu dusnatého katalyzuje oxidáciu etanolu na alfa-hydroxyetylradikál a acetaldehyd /
Vláda Ruskej federácie s pomocou legislatívy o spotrebnej dani obmedzila výrobu etylalkoholu ako motorového paliva stanovením vysokej sadzby spotrebnej dane na etylalkohol. Technológia výroby butanolu z etylalkoholu je jednoduchá. Výroba butanolu je oslobodená od spotrebnej dane. Šéf ruských technológií Sergej Chemezov si je istý, že biobutanol z hydrolýzy v Tulune bude veľmi žiadaný. Butanol naplnil tri autá, ktoré sa zúčastnili rally Irkutsk-Togliatti
1. Oxidácia etanolom na získanie acetaldehydu (acetaldehydu)
Hlavnou priemyselnou metódou výroby acetaldehydu CH 3 CHO je oxidácia etylénu v prítomnosti vodných roztokov chloridov paládia a medi. Proces sa nazýva oxidácia etylénu v kvapalnej fáze kyslíkom, ktorý prechádza cez vodný roztok PdCl2 a СuСl2, potom sa izoluje destiláciou; výťažok je asi 98 %. V roku 2003 bola celosvetová produkcia acetaldehydu asi milión ton ročne.
2 CH 2 \u003d CH 2 + O 2 → 2 CH 3 CHO
Tento proces má však množstvo nevýhod. Táto metóda sa vyznačuje tvorbou množstva toxických vedľajších produktov, ako je metylchlorid, etylchlorid a chlóracetaldehyd, ktoré sa musia zlikvidovať alebo podrobiť špeciálnemu spracovaniu, aby sa zabránilo znečisteniu životného prostredia. Okrem toho vzniká kyselina octová a krotonický aldehyd, ktoré sú rozpustené v obrovských množstvách vody, čo je nevyhnutné na izoláciu výsledného acetaldehydu zo zmesi plynných produktov. Takže na 1 tonu vyrobeného acetaldehydu pripadá 8 - 10 m3 odpadovej vody. Navyše etylén používaný v tomto procese ako surovina, ktorej výroba je založená na spracovaní ropných surovín, stále rastie. Zmluvné ceny etylénu na európskom trhu v štvrtom štvrťroku 2004 dosiahli 700 eur za tonu, čo je o 70 eur viac ako v predchádzajúcom štvrťroku, av septembri 2004 bola zaznamenaná maximálna cenová hladina 1020 eur za tonu.
Spolu s tým nestratil svoju praktickú hodnotu, proces získavania acetaldehydu katalytickou dehydrogenáciou etylalkoholu (etanolu)široko používané v 60. a 70. rokoch minulého storočia. Táto metóda má množstvo výhod, ako je absencia toxického odpadu, pomerne mierne podmienky procesu a tvorba vodíka spolu s acetaldehydom, ktorý sa môže použiť v iných procesoch. Surovinou je iba etylalkohol,
Acetaldehyd (acetický aldehyd) sa vyrába z etylalkoholu katalytickou elimináciou vodíka pri ~400 °C. Hydrogenácia a dehydrogenácia sú dôležité metódy pre katalytickú syntézu rôznych organických látok na báze reakcií redoxného typu spojených s mobilnou rovnováhou.
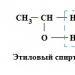
C2H5OH → CH3CHO + H2

Zvýšenie teploty a zníženie tlaku H2 prispievajú k tvorbe acetaldehydu a zníženie teploty a zvýšenie tlaku H2 - tvorba etylalkoholu; takýto vplyv podmienok je typický pre všetky reakcie hydrogenácia a dehydrogenácie. Katalyzátory hydrogenácia a dehydrogenácie sú mnohé kovy (Fe, Ni, Co, Pt, Pd, Os atď.), oxidy (Ni O, Co O, Cr 2 O 3, Mo O 2 atď.), ako aj sulfidy (WS 2 , Po S 2 , Kr n S m).
Dehydrogenácia alkoholov je jedným z najjednoduchších príkladov dehydrogenácie. Keď primárne alebo sekundárne alkoholy prechádzajú cez povrch jemne rozptýlených kovov (meď alebo železo), atómy vodíka sa odštiepia od uhlíka alkoholu a kyslíka hydroxylovej skupiny (dehydrogenačná reakcia). V tomto prípade sa tvorí plynný vodík a z primárneho alkoholu - aldehydu a zo sekundárneho - ketónu. Značné množstvo acetaldehyd v Rusku sa vyrábala dehydrogenáciou z
Pre informáciu:
Acetaldehyd (acetický aldehyd) je hlavným produktom rozkladu etanolu.
Acetaldehyd (acetaldehyd) vzniká oxidáciou etanolu, pričom oxidačná reakcia etanolu je katalyzovaná/urýchľovaná najmä alkoholdehydrogenázou. Napríklad, v ľudskej pečeni enzým (t. j. enzým) alkoholdehydrogenáza oxiduje etanol na acetaldehyd, ktorý sa ďalej oxiduje na neškodnú kyselinu octovú pomocou cetaldehyddehydrogenázy. Tieto dve oxidačné reakcie sú spojené s redukciou NAD+ v NADH
Počas pôsobenia enzýmov uvedených v diagrame na etylalkohol - alkoholdehydrogenázy a aldehyddehydrogenázy - sa na metabolickom procese musí zúčastniť ešte jedna látka. Je to derivát NAD kyseliny nikotínovej. NAD prispieva k začleneniu alkoholu aj acetaldehydu do metabolických procesov (spaľovanie), pričom sa sám premieňa na inú látku - NADH. Aby sa spracovanie etylalkoholu neprerušilo, pečeň musí premeniť NADH na NAD.
Ak obidva procesy zobrazené v spodnej časti tabuľky etylalkohol-acetát efektívne fungujú, telo nebude ohrozené nepríjemnými následkami pitia známymi ako kocovina – až na pár výnimiek, s ktorými sa dá poradiť.
Ak by sme pili čistý etylalkohol (aj keď zriedený vodou), potom je všetko, čo je potrebné od pečene, vyššie uvedené.  Bohužiaľ, nápoje, ktoré pijeme večer alebo na večeru, nie sú také čisté. Získavajú sa destiláciou alebo fermentáciou, obsahujú toxické chemikálie. Ide o takzvané nečistoty – teda látky sprevádzajúce etylalkohol. Patria sem fuselové oleje, organické kyseliny a dokonca aj aldehydy. Medzi týmito látkami sa nachádzajú také toxické látky, že ich príjem v čistej forme by viedol k smrti. Aby ste sa takémuto nebezpečenstvu vyhli, je najlepšie piť alkohol čo najčistejší – teda biele víno namiesto červeného, vodku namiesto whisky. Na obnovenie dobrého zdravia musia byť nečistoty, ktoré vstupujú do tela s alkoholom, zahrnuté do metabolických procesov alebo zničené spolu s alkoholom a jeho vedľajšími produktmi.
Bohužiaľ, nápoje, ktoré pijeme večer alebo na večeru, nie sú také čisté. Získavajú sa destiláciou alebo fermentáciou, obsahujú toxické chemikálie. Ide o takzvané nečistoty – teda látky sprevádzajúce etylalkohol. Patria sem fuselové oleje, organické kyseliny a dokonca aj aldehydy. Medzi týmito látkami sa nachádzajú také toxické látky, že ich príjem v čistej forme by viedol k smrti. Aby ste sa takémuto nebezpečenstvu vyhli, je najlepšie piť alkohol čo najčistejší – teda biele víno namiesto červeného, vodku namiesto whisky. Na obnovenie dobrého zdravia musia byť nečistoty, ktoré vstupujú do tela s alkoholom, zahrnuté do metabolických procesov alebo zničené spolu s alkoholom a jeho vedľajšími produktmi.
Vzhľadom na vyššie uvedené veľmi dôležité sú niektoré alternatívne metódy riešenia kocoviny. Po prvé, rýchlosť, ktorou alkohol vstupuje do tela, musí zodpovedať jeho schopnosti spracovať alkohol acetaldehyd a potom na acetát. Táto schopnosť sa umocňuje správnym jedlom vopred a výber jedál je ľahostajný. Mastné jedlá premazávajú steny žalúdka a dvanástnika a spomaľujú vstrebávanie alkoholu, bielkoviny pomáhajú normalizovať metabolické procesy a sacharidy adsorbujú alkohol v žalúdku a znižujú intenzitu jeho vstupu do krvného obehu a svalového tkaniva.
Po druhé, ak sú v nápoji nečistoty – povedzme aldehydy – mali by sa zlikvidovať. Máme pred sebou dve cesty. Je lepšie zbierať a absorbovať acetaldehyd pred vstupom do krvi (to isté platí pre acetát). Vhodné na toto Drevené uhlie je výborný adsorbent. Nie menej známe bežným pijanom sú takzvané chelátové zlúčeniny, ktoré sa nachádzajú napríklad v kapuste. Tieto látky viažu škodlivé prvky a odstraňujú ich z tela. To isté platí pre vitamín C.
Druhým menej žiadúcim spôsobom je spracovanie toxínov v tele v dôsledku metabolizmu. Táto metóda nie je taká účinná: môže byť ťažké dokončiť cyklus konverzie NAD-NADH-NAD na podporu metabolizmu. Tu môže pomôcť fruktóza, ktorá je v mede bohatá, a kyslík.
Biotechnológia umožňuje výrobu etylalkoholu pomocou technológií šetrných k životnému prostrediu z plodín obsahujúcich škrob, ako aj poľnohospodárskych plodín s obsahom cukru, z organického odpadu a biomasy (celulózy) hydrolýzou / konverziou enzýmami mikrobiálneho pôvodu. Rastlinná biomasa (celulóza), ktorej úloha v priemyselnej organickej syntéze neustále narastá s vyčerpávaním zásob ropy a plynu, je zároveň obnoviteľným zdrojom organických surovín a vďaka obrovskému ročnému nárastu je schopná úplne vyriešiť ľudská potreba palív a chemických produktov. Možnosť využitia na biologické spracovanie odpadov a vedľajších produktov umožňuje vytvárať prakticky bezodpadovú výrobu. Okrem toho, podľa údajov z oficiálnej webovej stránky dánskej spoločnosti „Novozymes“, 14. apríla 2005, www.novozvmes.com, nedávny pokrok v enzýmovom priemysle vedie k výraznému zníženiu nákladov na výrobu bioetanolu. Na americkom trhu veľkoobchodné ceny bioetanolu klesli o 20 % v porovnaní so septembrom 2004 a začiatkom apríla 2005 dosiahli 44 USD za barel. Takto získaný bioetanol sa vo svetle najnovších trendov v znižovaní a postupnom upúšťaní od používania ropných surovín stáva veľmi perspektívnym medziproduktom organickej syntézy a možno ho použiť na výrobu cenných chemických zlúčenín, najmä pre syntéza acetaldehydu.
2. Získavanie butanolu z acetaldehydu (acetaldehyd)
V USA sa ročne vyrobí asi 1,39 miliardy litrov butanol. Od acetaldehyd (acetaldehyd) cez acetaldol a krotónaldehyd (kondenzácia aldolu a krotónu), ktorý sa hydrogenuje na medených, meď-chrómových alebo niklových katalyzátoroch.
Kondenzačné reakcie sa zvyčajne nazývajú rôzne procesy zhutňovania organických molekúl, čo vedie k tvorbe zložitejších zlúčenín v dôsledku vzniku nových väzieb medzi atómami uhlíka.
Ako príklad uveďme kondenzáciu acetaldehydu pod vplyvom zriedených alkálií (A.P. Borodin, 1863-1873), pri ktorej do reakcie vstupujú dve molekuly aldehydu; jedna reaguje s karbonylovou skupinou a druhá s atómom uhlíka v polohe a na karbonylovú skupinu obsahujúcu mobilný atóm uhlíka, podľa schémy
V dôsledku toho vzniká nová väzba uhlík-uhlík a vzniká látka obsahujúca aldehydové aj alkoholové skupiny; bolo to pomenované aldol(Aldol je skratka pre slovo aldehyd aldol aldehydalkohol) a kondenzácia karbonylových zlúčenín, ktorá prebieha touto cestou a vedie k látkam, ako je aldol, sa nazývaaldolová kondenzačná reakcia.
Na aldolovej kondenzácii sa môžu podieľať molekuly rôznych aldehydov, ako aj molekuly aldehydov a ketónov. Tieto reagujú na úkor atómov uhlíka a vodíka nachádzajúcich sa v polohe a k ich karbonylovej skupine; samotná karbonylová skupina je v týchto reakciách menej aktívna ako karbonylová skupina aldehydov.
Za vhodných podmienok sa reakcia aldolovej kondenzácie dvoch molekúl aldehydu alebo molekuly aldehydu a ketónu nezastaví pri tvorbe aldolu; môže ísť ďalej s elimináciou vody vďaka mobilnému vodíku v polohe α ku karbonylovej skupine a hydroxylu na β-atóme uhlíka (t.j. na druhom z karbonylovej skupiny). V tomto prípade v dôsledku interakcie dvoch molekúl aldehydu vzniká cez aldol nenasýtený (krotonický) aldehyd.
Z acetaldehydu (acetaldehydu) sa týmto spôsobom získava krotónaldehyd, z ktorého názvu sa nazýva kondenzácia karbonylových molekúl, prebiehajúca s uvoľňovaním vody.krotónová kondenzácia
Získavanie alkoholov z aldehydov a ketónov.
Už sme videli, že pri oxidácii primárnych a sekundárnych alkoholov vznikajú látky s karbonylovou skupinou – aldehydy a ketóny. Aldehydy a ketóny, keď sú vystavené vodíku v čase izolácie*, sa opäť redukujú na alkoholy. V tomto prípade je dvojitá väzba karbonylovej skupiny prerušená a jeden atóm uhlíka je pripojený k uhlíku a druhý k kyslíku. V dôsledku toho sa karbonylová skupina stáva alkoholom.
* Plynný vodík H 2 je za normálnych podmienok inertný. Atómový vodík, ktorý sa uvoľňuje počas reakcie zlúčeniny, je veľmi aktívny. Tento vodík sa nazýva vodíka v čase uvoľnenia.
3. Oxidačná dehydrogenácia etylalkoholu na acetaldehyd na katalyzátore Sibunit
Na efektívnu realizáciu procesu dehydrogenácie etylalkoholu na acetaldehyd so všetkými vyššie uvedenými výhodami je potrebné vyvinúť nové vysoko aktívne, selektívne a stabilné katalytické systémy. To umožní prejsť na spôsob výroby acetaldehydu, ktorý je šetrnejší k životnému prostrediu a čo je dôležité, nezávislý od ropných surovín, čo priaznivo ovplyvní ekonomiku procesu.
Dôležitou etapou vo vývoji katalytických systémov je hľadanie katalyzátorového nosiča, ktorý má veľký vplyv na štruktúru a katalytické vlastnosti systémov. V poslednej dobe sa v heterogénnych katalytických procesoch čoraz viac používajú uhlíkové materiály rôznych typov, ako je grafit, koks, uhlíkové vlákna, diamant, rôzne druhy sadzí a aktívne uhlie. Jedným z najsľubnejších na použitie v katalýze je uhlíkový materiál sibunit, čo je nová trieda poréznych uhlíkovo-uhlíkových kompozitných materiálov. Spája v sebe výhody grafitu (chemická stabilita, elektrická vodivosť) a aktívneho uhlia (vysoká povrchová a adsorpčná kapacita). Okrem toho je veľmi dôležitou výhodou jeho vysoká chemická čistota. Podiel minerálnych nečistôt v sibunite nie je väčší ako 1%, pričom hlavný rad aktívneho uhlia má obsah popola 5% a viac, čo má významný priaznivý vplyv na selektivitu katalytických systémov pripravených na báze sibunitu. Táto dizertačná práca je venovaná vývoju nových aktívnych a selektívnych katalyzátorov pre syntézu acetaldehydu dehydrogenáciou etanolu s použitím sibunitového uhlíkového materiálu ako nosiča, ako aj určovaniu optimálnych podmienok pre proces na zabezpečenie efektívnosti požadovanej pre priemyselné aplikácie. Práce boli realizované na Katedre technológie petrochemickej syntézy a umelých kvapalných palív. A.N. Bashkirov Moskovská štátna akadémia jemných chemických technológií. M.V. Lomonosova v súlade s programom "Vedecký výskum vysokoškolského vzdelávania v prioritných oblastiach vedy a techniky." Vedecká novinka. Prvýkrát bol systematicky študovaný proces syntézy acetaldehydu dehydrogenáciou etylalkoholu v prítomnosti katalyzátorov obsahujúcich meď na báze uhlíkovo-uhlíkového kompozitného materiálu Sibunit. Prvýkrát sa ukázalo, že katalyzátor obsahujúci meď na báze sibunitu je najúčinnejší pri reakcii dehydrogenácie etanolu, pretože na rozdiel od oxidových nosičov nedochádza k vedľajším reakciám v prítomnosti sibunitu, čo umožnilo zvýšiť selektivita študovaných katalyzátorov pri syntéze acetaldehydu. Boli študované katalytické vlastnosti systémov obsahujúcich meď na báze sibunitu v závislosti od podmienok ich predúpravy a prítomnosti pomocných prísad. praktickú hodnotu. Boli vyvinuté účinné katalytické systémy obsahujúce meď na syntézu acetaldehydu na báze uhlíkovo-uhlíkového kompozitného materiálu Sibunit. Boli vypracované odporúčania pre technologický návrh procesu syntézy acetaldehydu katalytickou dehydrogenáciou etanolu, ktorý je možné využiť pri návrhu výrobných zariadení. Hlavný obsah dizertačnej práce je prezentovaný v týchto publikáciách: G. Egorova E.V., Trusov A.I., Nugmanov E.R., Antonyuk N., Frantsuzov V.K. Použitie uhlíkových materiálov ako nosičov pre katalyzátory na dehydrogenáciu alkoholov s nízkou molekulovou hmotnosťou
5. Získanie butanolu. Parná oxidácia dietyléteru.
Tvorba esterov.
Alkoholy reagujú s kyselinami; uvoľňuje sa voda a vzniká tvorba estery. Reakcia alkoholov s kyselinami je tzv esterifikačná reakcia. S organickými karboxylovými kyselinami sa postupuje podľa schémyAko uvidíme neskôr, estery sa ľahko hydrolyzujú, teda pôsobením vody sa rozkladajú na počiatočný alkohol a kyselinu, takže esterifikačná reakcia je vratná a dosahuje stav chemickej rovnováhy. Podrobnejšie sa tejto reakcii, ako aj vlastnostiam esterov, budeme venovať, keď sa zoznámime s organickými kyselinami. Tu len poznamenáme, že priebeh esterifikačnej reakcie, ako ukázal N. A. Menshutkin (1877), závisí od štruktúry alkoholu a kyseliny; Najľahšie sa esterifikujú primárne alkoholy, ťažšie sa esterifikujú sekundárne alkoholy a najťažšie sa esterifikujú terciárne alkoholy.
Alkoholy tvoria estery s anorganickými (minerálnymi) kyselinami. Estery kyseliny dusičnej sú teda známe (dusičnanové estery)
Pri reakcii alkoholov s viacsýtnymi kyselinami, ak reaguje iba jedna hydroxylová skupina kyseliny, vznikajú estery kyselín. Napríklad dvojsýtna kyselina sírová tvorí estery kyselín tzv alkylsírové kyseliny
Alkylsírové kyseliny vznikajú ako medziprodukty reakcií hydratácie nenasýtených uhľovodíkov a dehydratácie alkoholov pôsobením kyseliny sírovej.
Pôsobením činidiel odstraňujúcich vodu, napríklad pri zahrievaní s koncentrovanou kyselinou sírovou, strácajú alkoholy molekulu vody; okrem toho v závislosti od reakčnej teploty a kvantitatívnych pomerov alkoholu a kyseliny sírovej sú možné dva prípady dehydratácie. V jednom z nich dochádza k odberu vody intramolekulárne, t.j. vďaka jednej molekule alkoholu, s tvorbou uhľovodíka etylénu
V inom prípade pri nadbytku alkoholu prebieha dehydratácia intermolekulárny, t.j. izoláciou molekuly vody na úkor hydroxylových skupín dvoch molekúl alkoholu; tým vzniká tzv étery:
Úloha kyseliny sírovej pri intramolekulárnej dehydratácii alkoholov, ktorá vedie k produkcii etylénových uhľovodíkov, už bola zvážená,
Dietyl(etyl)éter. Má veľký praktický význam; zvyčajne sa to nazýva jednoducho éter. Získava sa najmä dehydratáciou etylalkoholu pôsobením koncentrovanej kyseliny sírovej. Touto metódou získal dietyléter prvýkrát už v roku 1540 V. Kordus; dietyléter bol dlhý čas nesprávne pomenovaný éter síry, keďže mala obsahovať síru. V súčasnosti sa dietyléter získava rovnakým spôsobom prechodom pár etylalkoholu cez oxid hlinitý
Al 203, zahriaty na 240-260 °C.Dietyléter je bezfarebná, prchavá kvapalina s charakteristickým zápachom. Tempo. balík 35,6 ° С, rýchlosť mrazu - 117,6 ° С; cp = 0,714, t.j. éter je ľahší ako voda. Ak sa pretrepe vodou, potom sa éter pri státí „odlupuje“ a pláva na povrch vody a vytvára hornú vrstvu. Určité množstvo éteru sa však rozpúšťa vo vode (6,5 hodiny v 100 hodinách vody pri 20°C). Na druhej strane sa pri rovnakej teplote rozpustí 1,25 dielu vody v 100 dieloch éteru. Éter sa veľmi dobre mieša s alkoholom.
Je dôležité mať na pamäti, že s éterom sa musí zaobchádzať opatrne: je veľmi horľavý a jeho pary so vzduchom tvoria výbušné - výbušné zmesi. Navyše pri dlhodobom skladovaní, najmä na svetle, dochádza k oxidácii éteru vzdušným kyslíkom a k tzv. peroxidové zlúčeniny*; ten sa pri zahrievaní môže rozložiť výbuchom. Takéto výbuchy sú možné pri destilácii éteru, ktorý dlho stál.
Kyselina jodovodíková rozkladá étery; výsledkom je halogénalkyl (jódový derivát) a alkohol
Wurtzova syntéza spočíva v získavaní uhľovodíkov z halogénderivátov pôsobením kovového sodíka na ne. Reakcia prebieha podľa schémy
Napríklad,
Z butánu možno izomerizáciou získať izobután, ktorý môže slúžiť ako surovina na výrobu izobutylénu dehydrogenáciou izobutánu. Následnou esterifikáciou izobutylénu etylalkoholom vzniká prísada do benzínu obsahujúca kyslík - ekologický etyl-terc-butyléter (ETBE) s oktánovým číslom 112 bodov (metóda výskumu).
Fyzikálne vlastnosti primárnych halogénalkylov s normálnym reťazcom
| Chlorid | bromid | jodid | |||||
| titul | štruktúru | bod varu, °C | d 4 20 | bod varu, °C | d4 20 | bod varu, °C | d 4 20 |
| Metyl | CH 3 - | -23,7 | 0,992* | +4,5 | 1,732** | + 42,5 | 2,279 |
| Etyl | CH 3 - CH 2 - | + 13,1 | 0,926*** | +38,4 | 1,461 | +72,3 | 1,936 |
| Propil | CH 3 - CH 2 - CH 2 - | + 46,6 | 0,892 | +71,0 | 1,351 | + 102,5 | 1,749 |
| Butyl | CH3 - (CH 2) 2 - CH 2 - | +78,5 | 0,887 | + 101,6 | 1,276 | + 130,4 | 1,615 |
| Amyl | CH 3 - (CH 2) 2 - CH 2 - | + 108,4 | 0,878 | + 127,9 | 1,218 | +154,2 | 1,510 |
| Hexyl | CH 3 - (CH 2) 4 - CH 2 - | + 132,9 | 0,876 | + 153,2 | 1,176 | + 177,0 | 1,439 |
* Pri bode varu.
***d40
V prítomnosti katalyzátorov pri vysokých teplotách dochádza k odštiepeniu vodíka (dehydrogenačnej reakcii) z molekúl nasýtených uhľovodíkov za vzniku dvojitých väzieb. Keď teda bután prechádza cez katalyzátor obsahujúci oxidy ťažkých kovov (napr.
Cr2O3 ), pri teplotách 400 - 600º vzniká zmes butylénovPrísun vody (hydratačná reakcia). Za normálnych podmienok etylénové uhľovodíky nereagujú s vodou, ale pri zahrievaní v prítomnosti katalyzátorov (chlorid zinočnatý, kyselina sírová) sa k atómom uhlíka v mieste dvojitej väzby pridávajú vodné prvky (vodík a hydroxyl) za vzniku alkoholov.
S homológmi etylénu prebieha reakcia podľa Morkovnikovovho pravidla: vodík vody sa pridáva k uhlíku, na ktorom je viac atómov uhlíka, a hydroxyl k uhlíku, na ktorom je menej alebo žiadne atómy vodíka.
Táto metóda dáva špeciálnu možnosť použiť ako surovinu na výrobu butánu, butylalkoholu ... etylalkoholu
Veľkou zaujímavosťou je výroba izobutylénu z etylalkoholu. Po prvé, normálny bután (n-bután) sa získa z etanolu, ako je opísané vyššie. Izobután sa získava z n-butánu katalyzovanou izomerizáciou. Z izobutánu sa získava izobutylén – ako surovina na výrobu antidetonačnej prísady do benzínu – etylterc-butyléter ETBE. Táto metóda dáva špeciálnu príležitosť použiť etylalkohol ako surovinu na výrobu izobutylénu. Na získanie ETBE sa teda používa iba etylalkohol bez izobutylénu.
1. Lebedev N.N. Chémia a technológia základných organických a petrochemických syntéz. 4. vyd. Moskva: Chémia, 1988. 592 s.
2. Timofeev B.C., Serafimov L.A. Princípy základnej technológie organickej a petrochemickej syntézy. 2. vyd. M.: Vyššia škola, 2003. 536 s.
3. Steppich W., Sartorius R. Spôsob výroby acetaldehydu. U.S. Patent 4237073, dec. 2, 1980 (US CI. 568/401).
4. Khcheyan X.E., Lange C.A., Ioffe A.E., Avrekh G.L. Výroba acetaldehydu. M.: TsNIITE Neftekhim, 1979. 40 s.
5. Kuznecov B.N. Rastlinná biomasa je alternatívnou surovinou pre nízkotonážnu organickú syntézu Ros. chem. časopis (Ž. Ros. chem. ob-va pomenovaná po D.I. Mendelejevovi). 2003, ročník XLVII, 6. 3.
6. Kukharenko A.A., Vinarov A.Yu., Sidorenko T.E., Boyarinov A.I. Intenzifikácia mikrobiologického procesu získavania etanolu zo surovín obsahujúcich škrob a celulózu. M., 1999. 90 s.
7. Plaksin G.V. Porézne uhlíkové materiály ako sibunit. Chémia pre trvalo udržateľný rozvoj. 2001, č. 9. 609-620.
8. Semikolenov V.A. Moderné prístupy k príprave katalyzátorov "Pallady!! na rohu." pokroky v chémii. 1992, v. 61, č. 2. 320-331.
9. Berg World analýza palivového etanolu a výhľad "P.O. Licht" agentúra. http://www.distill.com/World-Fuel-Ethanol-A&O-2004.html lO.Berg C. Svetová produkcia etanolu a obchod s ním do roku 2000 a ďalej Agentúra „P.O. Licht“. http://www.distill.eom/ber.g/ P.Volkov B.V., Fadeev A.G., Khotimsky B.C., Buzin O.I., Tsodikov M.V., Yandieva F.A., Moiseev I.I. Ekologické palivo z biomasy Ros. chem. časopis (Ž. Ros. chem. ob-va pomenovaná po D.I. Mendelejevovi). 2003, ročník XLVII, 6. P 71-82. 188
10. Kadieva A.T. Vývoj intenzívnej etanolovej technológie založenej na cielenom použití multienzýmových systémov a nových rás alkoholických kvasiniek: Dis....cand. tie. vedy. Moskva, 2003.
11. Lukerčenko V.N. Neškrobové obilné sacharidy a ich význam pre výrobu alkoholu Potravinársky priemysel. 2000, č. 1. 62-63.
12. Rimareva L.V. Technológia získavania perspektívnych enzýmových prípravkov a vlastnosti ich použitia v liehovare Moderné a progresívne technológie a zariadenia v liehovarníckom priemysle a liehovinách 2. medzinárodná vedecko-praktická konferencia. Moskva: Piščepromizdat, 2000. 48-63. 1 Z. Kalinina O.A. Vývoj technológie šetriacej zdroje na výrobu etanolu z ražného zrna: Dis....cand. tie. vedy. Moskva, 2002.
13. Lichtenberg L.A. Výroba liehu z obilia Potravinársky priemysel. -2000, 7 C 52-54.
14. Technológia alkoholu. Ed. V.L. Yarovenko, M.: Kolos, 1999. 464 s.
15. Rimareva L.V., Overchenko M.B., Trifonova V.V., Ignatova N.I. Osmofilné kvasinky na kvasenie vysoko koncentrovanej mladiny Výroba alkoholu a likérov. 2001, č. 1. 21-23.
16. V. A. Bondarenko, V. L. Kasperovich, V. A. Butsko a E. Sh. Spôsob prípravy surovín obsahujúcich obilný škrob na alkoholovú fermentáciu. RF patent č. 2145354, Appl. 24.11.1998, publ. 10. februára 2000 (IPC C12 R7/06).
17. Sviridov B.D., Lebedev Yu.A., Zaripov R.Kh., Kutepov A.M., Antonyuk A.V. Spôsob výroby etylalkoholu z obilných surovín. RF patent 2165456, Appl. 19.05.2000, publ. 20.04.2001 (IPC C12 R7/06).
18. Timoshkina N.E., Kretechnikova A.N., Imyashenko N.G., Shanenko E.F., Gernet M.V., Kirdyashkin V.V. Spôsob spracovania kvasníc. RF patent č. 2163636, Appl. 30.03.2000, zverejnené. 27.02.2001 (IPC С12 N1/16).
19. Zhurba O.S. Vývoj novej etanolovej technológie založenej na intenzívnych metódach spracovania pšeničného zrna: Dis....cand. tie. vedy. Moskva, 2004. 189
20. Vasiľeva N.Ya., Rimareva L.V. Fermentácia surovín s obsahom škrobu anaeróbnymi baktériami rodu Zymomonas Výroba alkoholu a alkoholických nápojov. 2001, č. 1. 18-20. 25. Fedorov A.D., Kesel B.A., Dyakonsky P.I., Naumova R.P., Zaripova K., Veseliev D.A. Spôsob výroby etylalkoholu. RF patent 2138555, Appl. 12.05.1997, publ. 27.09.1999 (IPC C12 R7 / 06).
21. Ledenev V.P. Stav a úlohy na zlepšenie technológie výroby alkoholu z obilia v závodoch Ruskej federácie. Enzýmy v potravinárskom priemysle. Abstrakty z konferencie. M., 1999. 22-27.
22. Mulder M.H.V., Smolders A., Bargeman D. Membraan filtratie bij de productie van ethanol PT Procestechniek. 1981, 36, č.12. S. 604-607.
23. Mori Y., Inaba T. Výroba etanolu zo škrobu v pervaporačnom membránovom bioreaktore s použitím biotechnológie a bioinžinierstva Clostridium thermohydrosulfuricum. 1990, v. 36, 8. str. 849-853.
24. Gamil A. Konverzia častíc cukrovej repy na etanol baktériou Zymomonas mobilis pri fermentácii v tuhom stave Biotechnology Letters. 1992, 14, 6 P 499-504.
25. Saxena A, Garg S.K., Verma J. Simultánne sacharifikácia a fermentácia odpadových novín na etanol Bioresour. technológie. 1992, 42, 1. S. 13-15.
26. Grohmann K., Baldwon E.A., Buslig B.S. Výroba etanolu z enzymaticky hydrolyzovanej pomarančovej kôry kvasinkami Saccharomyces cerevisiae // Applied Biochemistry and Biotechnology A. 1994, 45-46. S. 315-327.
27. Mangueva 3.M. Vzorce rastu bunkovej kultúry Saccharomyces cerevisiae (vini)Y 2217 pri biosyntéze etanolu z marhuľového muštu: Abstrakt práce. cand. chem. vedy. Machačkala, 2004. 190
28. Tolan J.S. logens proces výroby etanolu z celulózovej biomasy Clean Techn. Environ. politika. 2002, č. 3. p. 339-345.
29. Loktev S.M., Korneeva G.A., Mosesov A.Sh., Kuimova M.E. Získavanie produktov základnej organickej syntézy z najjednoduchších zlúčenín uhlíka. M.: VNTICenter, 1985. 132 s. Zb.Putov N.M. Výroba kyseliny octovej a acetanhydridu v zahraničí. M.: Goshimizdat, 1948. 56 s.
30. Kalfus M.K., Khasanov A.S. Priemyselná oxidácia acetaldehydu v kvapalnej fáze na kyselinu octovú. Alma-Ata, 1958. 16 s.
31. Chashchin A.M., Glukhareva M.I. Výroba acetátových rozpúšťadiel v drevochemickom priemysle. M.: Les. priemysel, 1984. 240 s.
32. Chernyak B.I., Savitsky Yu.V., Ernovsky N.P., Vvasilenko O.R., Kibin F.S., Vine V.V., Kravtsov N.I. Spôsob získania etylacetátu. RU 2035450 C1, prihláška. 4.1.1991, krč. 20. mája 1995 (IPC C07 C69/14).
33. Wittcoff N.A. Acetaldehyd: chemikália, ktorej bohatstvo zmenilo Journal of chemical education. 1983, 60, č.12. S. 1044-1047.
34. Yalter Yu.A., Brodsky M.S., Feldman B.M. Spôsob získania glyoxalu, A.S. č. 549457, prihláška. 8.8.1974, krč. 3.5.1977 (IPC C07 C47 / 127). 42, Lehmann R.L., Lintner J. Výroba glyoxalu a polyglyoxalu. US patent 2599355, 3. júna 1952 (US CI. 568/458).
35. Chemická encyklopédia: V 5 zväzkoch: v. 3. Ed. Kol.: Knunyants I.L. (ch.; vyd.) a i. Moskva: Veľká ruská encyklopédia, 1992. 639 s. 44. Eek L. Spôsob prípravy pentaerytritolu. U.S. Patent 5741956, apríl. 21, 1998 (US CI. 568/853).
36. Vebel H.I., Moll K.K., Muchlstacdt M. Príprava 3-metylpyridínu Chemishe Technik. 1970.22, č. 12. P. 745-752.
37. Dinkel P. Spôsob získania 3-pikolínu. SU 1095876 A, Appl. 22.05.1981, krč. 30. mája 1984 (IPC C07 D213/10). 191
38. Ladd E.S. Výroba ketoesterov. U.S. Patent 2533944, dec. 12, 1950 (US CI. 560/238).
39. Vinogradov M.G., Nikishin G.I., Stepanova G.A., Markevich B.C., Markevich S.M., Baybursky V.L. Spôsob získania y-acetopropylacetátu. A.S. 504753, App. 19.03.1973, krč. 28.02.1976 (IPC C07 C69 / 14).
40. Anikeev I.K., Madiyarova Kh.Sh., Nefyodov O.M., Nikishin G.I., Dolgii I.E., Vinogradov M.G. Spôsob výroby acetopropylalkoholacetátu. A.S. 614091, App. 6.9.1975, krč. 07.05.1978 (IPC C07 C69 / 14).
41. Tustin G.C., Zoeller J.R., Depew L.S. Spôsob prípravy vinylacetátu. US patent 5719315, feb. 17, 1998 (US CI. 560/238). 52. Wang C.-G. Príprava vinylacetátu. GB 2013184 A, dec. 29, 1978 (IPC C07 C69/15).
42. Eller K., Fiege B., Henne A., Kneuper H.-J. Príprava etyldiizopropylamínu. U.S. Patent 6111141, august. 29, 2000 (US CI. 564/473).
43. Wakasugi T., Miyakawa T., Suzuki F. Spôsob výroby triméru monochlóracetaldehydu a chloralu. US patent 5414139, 9. mája 1995 (US CI. 568/466).
44. Dhingra Y.R. Alfa chlorácia chloridov kyselín. Patent USA 3751461, august. 7, 1973 (US CI. 562/864).
45. Ebmeyer F., Metzenthin T., Siegemund G. Spôsob prípravy trichlóracetylchloridu. U.S. Patent 5659078, august. 19, 1997 (US CI. 562/864). 57. Abe T., Gotoh T., Uchiyama T., Hoguchi H., Shima Y., Ikemoto K. Proces prípravy laktátu. US patent 5824818, okt. 20, 1998 (US CI. 560/179).
46. Mladý D.C. Oxidácia olefínov. Patent USA 3850990, nov. 26, 1974 (US CI. 568/449).
47. Copelin H.B. Spôsob výroby acetaldehydu z etylénu. US patent 3531531, sept. 29, 1970 (US CI. 568/484). 192
48. Robinson D.V. Spôsob získania karbonylových zlúčenín. A.S. 444359, App. 12.7.1972, krč. 25.09.1974 (IPC C07 C47 / 07).
49. Nishimura Y., Yamada M., Arikawa Y., Kamiguchi T., Kuwahara T., Tanimoto H. Proces výroby acetaldehydu. US patent 4521631, jún. 4, 1985 (US CI. 568/478).
50. Sokolskij D.V., Nurgozhaeva Sh.Kh., Shekhovtsev V.V. Spôsob výroby acetaldehydu. A.S. 171860, App. 24.06.1964, krč. 22.06.1965 (С07 С47/06).
51. Flid R.M., Tyomkin O.N., Streley M.M. Spôsob výroby acetaldehydu. A.S. 175943, App. 26.09.1962, krčma. 26.10.1965 (IPC C07 C47/06).
52. Agladze R.I., Gegechkori V.L. Spôsob výroby acetaldehydu. A.S. 177870, App. 13.05.1963, krč. 1.8.1966 (IPC C07 C47 / 06).
53. Petrušova N.V., Kirillov I.P., Peskov B.P. Spôsob spoločnej výroby acetaldehydu a kyseliny octovej. A.S. Jb 387963, Appl. N 20.09.1971, vyhl. 22.06.1973 (IPC C07 C47 / 06).
54. Gorin Yu.A., Troitsky A.N., Makashina A.N., Gorn I.K., Derevyagina N.L., Mamontov B.V. et al., Spôsob získania octových a kratónových aldehydov hydratáciou acetylénu v plynnej fáze. A.S. 138607, App. 22.08.1960, krč. 1961 (IPC C07 C47/06).
55. Kirshenbaum I., Amir E.M., InchaHk J. Oxidácia alkoholov. U.S. Patent 3080426, Mar. 5, 1963 (US CI. 568/487).
56. Sanderson J.R., Markíz E.T. Oxidácia primárnych alkoholov na aldehydy s použitím ftalocynínov prechodných kovov ako katalyzátora. U.S. Patent 5132465, júl. 21, 1992 (US CI. 568/485). 70, Nagijev T.M., Zulfugarova C.3., Iskenderov P.A. Spôsob výroby acetaldehydu. A.S. 891623, App. 4.9.1980, krč. 23. 12. 1981 (IPC C07 C47/06). 193
57. Volkova A.N., Smirnov V.M., Koltsov S.I. Ivanova L.V., Yakovlev V.I. Spôsob prípravy strieborného katalyzátora na oxidáciu etylalkoholu. A.S. 753459, App. 4.12.1978, krč. 8.7.1980 (IPC C07 C47 / 07).
58. Hudlický M. Oxidácia v organickej chémii Monografia ACS. 1990, 186, s. 114-126.
59. Kannan S., Sivasanker S. Katalytické správanie molekulových sít obsahujúcich vanád na selektívnu oxidáciu etanolu 12-Proc. Int. Zeolitová konferencia. 1998 (Pub 1999), 2. S. 877 884.
60. Kozminykh O.K., Makarevich N.A., Ketov A.N., Kostin L.P., Burnyshev V.C. Spôsob výroby acetaldehydu. A.S. 352874, App. 22.05.1970, krč. 29.09.1972 (IPC C07 C47 / 06).
61. Aleksandrov Yu.A., Tarunin B.I., Pereplyotchikov M.L., Pereplyotchikova V.N., Klimova M.N. Spôsob výroby acetaldehydu. A.S. 891624, App. 16.11.1979, krč. 23. 12. 1081 (IPC C07 C47/06).
62. Pretzer W.R., Kobylinski T.P., Božik J.E. Spôsob selektívnej prípravy acetaldehydu z metanolu a syntézneho plynu. Patent USA 4151208, apríl. 24, 1979 (US CI. 568/487).
63. Pretzer W.R., Kobylinski T.P., Božik J.E. Spôsob výroby acetaldehydu. U.S. Patent 4239704, dec. 16, 1980 (US. CI. 568/487).
64. Keim K.-H., Kroff J. Spôsob výroby acetaldehydu a etanolu. GB 2088870 A, 4. decembra 1981 (IGJ C07 C47/06).
65. Pretzer W.R., Kobylinski T.P., Božik J.E. Spôsob výroby acetaldehydu. U.S. Patent 4239705, dec. 16, 1980 (US. CI. 568/487).
66 Larkin Jr. T.N., Steinmetz G.R. Spôsob prípravy acetaldehydu. US patent 4389532, jún. 21, 1983 (US CI. 568/487).
67. Rizkalla N. Príprava acetaldehydu. Patent USA 4628121, dec. 9, 1986 (US CI. 568/487).
68. Wegman R.W., Miller D.S. Syntéza aldehydov z alkoholov. US patent 4594463, jún. 10, 1986 (US CI. 568/487).
69. Walker W.E. Spôsob selektívnej hydroformylácie metanolu na acetaldehyd. US patent 4337365, jún. 29, 1982 (US CI. 568/487).
70. Porcelli R.V. Príprava acetaldehydu. Patent USA 4302611, nov. 24, 1981 (US CI. 568/484).
71. Hajime Y., Yoshikazu S. Spôsob výroby acetaldehydu. 256 249 JP sept. 19, 2000 (YYC C07 C45/54).
72. Isogai N., Hosokawa M., Okawa T., Wakui N., Watanabe T. Proces výroby acetaldehydu. Patent USA 4408080, okt. 4, 1983 (US CI. 568/484).
73. Nakamura S., Tamura M. Proces výroby acetaldehydu. US patent 4351964, sept. 28, 1982 (US CI. 568/484). 95. Moy D. Spôsob prípravy acetaldehydu. US patent 4356328, okt. 26, 1982 (US CI. 568/484). 195
74. Tustin G.S., Depew L.S., Collins N.A., Spôsob výroby acetaldehydu z kyseliny octovej. US patent 6121498, sept. 19, 2000 (US CI. 568/420).
75. Rachmady W., Vannice M.A. Redukcia kyseliny octovej na acetaldehyd cez železné katalyzátory. I. Kinetic behavior Journal of catalysis. 2002, 208, č. 1. S. 158-169.
76. Rachmady W., Vannice M.A. Redukcia kyseliny octovej na acetaldehyd cez železné katalyzátory. II. Charakterizácia pomocou Mossbauerovej spektroskopie, DRIFTS, TPD a TPR Journal of catalysis. 2002, 208, č. 1. S. 170-179.
77. Fenton D.M. Konverzia chlórmravčanov na aldehyd. U.S. Patent 3720718, Mar. 13, 1973 (US CI. 5.68/484).
78. Roscher G., Schmit K., Schmit T., Schmit H. Spôsob výroby acetaldehydu z vinilacetátu. U.S. Patent 3647882, Mar. 7, 1972 (US CI. 568/484).
79. Shostakovsky M.F., Azerbaev I.N., Yakubov R.D., Atavin A.S., Petrov L.P., Shvetsov N.V. atď. Spôsob výroby acetaldehydu. A.S. 222363, App. 27.12.1965, krč. 22.07.1962 (IPC C07 C47 / 06).
80. Parker R.T. Príprava aldehydov oxidáciou éterov vodnou parou. US patent 2477312, júl. 26, 1949 (US CI. 568/485).
81. Fenton D.M. Rozklad uhličitanov za vzniku aldehydov. U.S. Patent 3721714, Mar. 20, 1973 (US CI. 568/449).
82. Neely S.D. Konverzia etylalkoholu na acetaldehyd. US patent 3106581, okt. 8.1963 (US CI. 568/471). 105. MacLean A.F. Spôsob katalytickej dehydrogenácie alkoholov na karbonylové zlúčeniny. US patent 2634295, apríl. 7, 1953 (US CI. 568/406).
83. Marcinkowsky A.E., Henry J.P. Katalytická dehydrogenácia etanolu na výrobu acetaldehydu a kyseliny octovej. US patent 4220803, sept. 2, 1980 (US CI. 562/538).
84. Allahverdová H.X. Transformácie etanolu v plynnej fáze na produkty obsahujúce kyslík na komplexných oxidových katalyzátoroch. Abstract Dis. doktor chemických vied. Baku, 1993. 196
85. Backhaus A.A., Arentz F.B. Proces výroby aldehydov. Patent USA 1388841, august. 30, 1921 (US CI. 568/487).
86. Williams C.S. Spôsob výroby aldehydu kyseliny octovej. Patent USA 1555539, september. 29, 1925 (US CI. 568/487).
87. Raich B.A., Foley Henry C Dehydrogenácia etanolu s paládiovým membránovým reaktorom: alternatíva k Wacker chemistry Ind. Ing. Chem. Res. 1998, 37 P 3888-3895.
88. Matsumura Y., Hashimoto K., Yoshida S. Selektívna dehydrogenácia etanolu na vysoko dehydratovanom oxide kremičitom Journal of catalysis. 1989, 117. S. 135-143.
89. Carrasco-Marin F., Mueden A., Moreno-Castilla C Povrchovo upravené aktívne uhlie ako katalyzátory pre dehydratačné a dehydrogenačné reakcie etanolu Journal of Physical chemistry B. 1998, 102. P. 9239-9244. 114. Bo-Quing X., Tian-Xi C, Song L. Selektívna dehydrogenácia etanolu na acetaldehyd cez Na ZSM-5 kalcinovaný pri vysokej teplote Reakčná kinetika a písmená katalýzy. 1993, 49, č. S. 223-228.
90. Iwasa N., Takezawa N. Reformovanie dehydrogenácie etanolu na etylacetát a parné reformovanie na kyselinu octovú pomocou katalyzátorov na báze medi Bulletin chemickej spoločnosti Japonska. 1991, 64. S. 2619-2623.
91. Chen D.A., Freind C M Selektívna a neselektívna dehydrogenácia v primárnych alkoholoch: reakcie etanolu a 1-propanolu na Co-covered Mo (110) Langmuir.-1998, 14.-P. 1451-1457.
92. Idriss H., Seebauer E.G. Reakcie etanolu nad oxidmi kovov Journal of Molecular Catalysis A. 2000, 152. S. 201-212. 118. Kim K.S., Barteau M.A., Farneth W.E. Adsoftácia a rozklad alifatických alkoholov na Ti02 Langmuir. 1988.4, č. 3. S. 533-543. 197
93. Cong Y., Masel R.I., van Spaendonk V. Nízkoteplotné štiepenie väzby C-C počas rozkladu etanolu na Pt (331) Surface science. 1997, 385, č. 2-3.-P. 246-258.
94. Inui K., Kurabayashi T., Sato S. Priama syntéza etylacetátu uskutočnená pod tlakom Journal of catalysis. 2002, 212. S. 207-215.
95. Iwasa N., Yamamoto O., Tamura R., Nishikybo M., Takezawa N. Rozdiel v reaktivite acetaldehydových medziproduktov pri dehydrogenácii etanolu oproti katalyzátorom Pd na nosiči Katalyzačné písmená. 1999, 62. S. 179-184.
96. Matsumura Y., Hashimoto K., Yoshida S. Selektívna dehydrogenácia etanolu na acetaldehyd na silikalite-1 Journal of catalysis. 1990, 122. S. 352-361.
97. Chung M-J., Moon D-J., Kim H-S., Park K-Y., Ihm S-K. Vyššia tvorba oxygenátov z etanolu na katalyzátoroch Cu/ZnO: Synergizmus a reakčný mechanizmus Journal of Molecular Catalysis A. 1996, 113. S. 507-515.
98. Sexton B.A. Povrchové vibrácie adsorbovaných medziproduktov pri reakciách alkoholov s Cu(lOO) Náuka o povrchu. 1979, 82. str. 299-318.
99. Elliot D.J., Penella F. Tvorba ketónov v prítomnosti oxidu uhoľnatého nad CuO/ZnO/AbOa// Journal of catalysis. 1989, 119, č.2. S. 359ПТЗbSheldon P.A. Chemické produkty na báze syntézneho plynu. Za. z angličtiny. vyd. Lokteva SM. Moskva: Chémia, 1987. 248 s.
100. Matsumura Y., Hashimoto K., Watanabe S., Yoshida S. Dehydrogenácia etanolu na zeolitoch typu ZSM-5 Chemistry letters. 1981, č. S. 121-122. 129. J.M., Joshi H.K. Acetaldehyd dehydrogenáciou etylalkoholu Priemyselná a inžinierska chémia. -1951, august. P 1805-1811.
101. Spôsob dehydrogenácie alkoholov. GB 825602, 16.12.1959 (IPC C07 C45/00D). 198
102. Mladý CO. Spôsob výroby acetaldehydu a jeho katalyzátora. Patent USA 1977750, okt. 23, 1934 (US CI. 568/487).
103. Borisov A.M., Lapshov A.I., Malyutin N.R., Karasev V.N., Gaivoronsky V.I., Nikitin Yu.S., Bashilov L.S. Spôsob výroby acetaldehydu. A.S. 618368, App. 7.1.1974, krč. 8.5.1978 (IPC C07 C47 / 06). 134. Ty Y-J., Chen Y-W. Účinky aditív oxidu alkalických zemín na medené katalyzátory na nosiči oxidu kremičitého pri dehydrogenácii etanolu Ind. Ing. Chem. Res. 1998, 37 P 2618-2622.
104. Kanuon N., Astier M.P., Pajonk G.M. Selektívna dehydrogenácia etanolu na Cu katalyzátoroch obsahujúcich Zr alebo V a Zr React. Kinet. katal. Lett. 1991, 44, 1 P 51-56.
105. Kawamoto K., Nashimura Y. Katalytická reakcia alkoholov s redukovanou meďou Bulletin chemickej spoločnosti Japonska. 1971, 44. S. 819-825.
106. Komarewski V.I. Dehydrogenácia alkoholov. U.S. Patent 2884460, apríl. 28, 1959 (US CI. 568/485).
107. Sultanov A.S., Makhkamov X.M., Sapozhnikova E.A., Yanova A.E., Lapinov A.I., Borisov A.M. Spôsob výroby acetaldehydu. A.S. 433782, App. 24.02.1971, krč. 25.02.1976 (IPC C07 C47 / 06).
108. Teshchenko A.D., Kursevich O.V., Klevchenya D.I., Andreevsky D.N., Sachek A.I., Basiev I.M., Andreev V.A. Katalyzátor dehydrogenácie etanolu. A.S. č. 1109189, prihláška. 22.02.1981, krč. 23.08.1984. (IPC C07 C47/06).
109. Duncanson L.A., Charman N.V., Coffey R.S. Dehydrogenácia alkoholov. GB 1061045, 3.8.1967 (IPC C07 C45/00D).
110. Setterfield C. Praktický kurz heterogénnej katalýzy: TRANS. z angličtiny. M.: Mir, 1984.-520 s,
111. Savelyev A.P., Dyment O.N., Borisov A.M., Kantor A.Ya., Kaluzhsky A.A., Oleinikova N.S.
112. Areshidze Kh.I., Chivadze G.O., Iosiliani D.K. Spôsob výroby aldehydov a ketónov. A.S. č. 400570, prihláška. 12.7.1971, krč. 1. 10. 1973 (IPC C07 C47 / 06). 144. Veryovkin P.F., Malyutin N.R., Smirnov A.I. Spôsob výroby acetaldehydu. A.S. č. 191519, prihláška. 17.12.1965, krč. 26.01.1967 (IPC C07 C47 / 06).
113. Deng J., Cao Y., Liu B. Katalytická dehydrogenácia etanolu v Pd-M/y-AOs kompozitných membránových reaktoroch Applied Catalysis. 1997, 154, č.1-2. P. 129138.
114. Schmitt J.L., Walker P.L., Castellion G.A. Uhlíkové častice s kontrolovanou hustotou. U.S. Patent 4,029,600 Jun. 14, 1977 (US CI. 502/418).
115. Yermakov Yu.L, Surovikin V.F., Plaksin G.V., Semikolenov V.A., Likholobov V.A., Chuvalin L.V., Bogdanov S.V. Nový uhlíkový materiál ako nosič pre katalyzátory Reakčná kinetika a písmená katalýzy. 1987, 33, č.2. S. 435-440.
116. Surovikin V.F., Plaxin G.V., Semikolenov V.A., Likholobov V.A., Tiunova I.J. Porézny uhlíkatý materiál. U.S. Patent 4978649, dec. 18, 1990 (US CI. 502/416).
117. Surovikin V.F., Fenelonov V.B., Plaksin G.V., Semikolenov B.A., Okkel L.G. Vzory tvorby poréznej štruktúry kompozitov na báze pyrolytickej a technickej uhlíkovej chémie tuhých palív. 1995, č. 3. 62-68.
118. Gavrilov V.Yu., Fenelonov V.B., Chuvilin A.L., Plaksin G.V., Surovikin V.F., Ermakov Yu.I., Semikolenov V.A. Štúdium morfológie a poréznej štruktúry kompozitných uhlíkovo-uhlíkových materiálov Chémia tuhých palív. 1990, č. 2. 125-129.
119. Plaksin G.V., Surovikin V.F., Fenelonov V.B., Semikolenov V.A., Okkel L.G. Tvorba textúry nového uhlíkového nosiča pre katalyzátory Kinetika a katalýza. 1993.34, č. 6. 1079-1083. 200
120. Fenelonov V.B. Úvod
121. Semikolenov V.A. Návrh vysoko disperzných paládiových katalyzátorov na uhlíkovom nosiči Journal of Applied Chemistry. 1997, 70, č. 5.-S. 785-796.
122. Startsev A.N., Shkuropat A., Zaikovsky V.I., Moroz E.M., Ermakov Yu.I., Plaksin G.V., Tsekhanovič M.S., Surovkin V.F. Štruktúra a katalytické vlastnosti sulfidových hydrodesulfurizačných katalyzátorov na uhlíkovom nosiči Kinetika a katalýza. 1988, v. 29, č. 2. 398-405.
123. Korolkov V.V., Doronin V.P., Startsev A.N., Klimov O.V., Turekhanova R.N., Duplyakin V.K. Hydrodemetalizácia vanadylporfyrínov na Mo a Ni-Mo sulfidových katalyzátoroch podporovaných kinetikou a katalýzou Sibunit. 1994.35, č. 96-99.
124. Ryashentseva M.A., Avaev V.I. Hydrogenácia etylacetátu na nosičových réniových katalyzátoroch Zborník Akadémie vied. Chemická séria. 1999, č. 5.-S. 1006-1008.
125. Ryashentseva M.A. Vlastnosti nanesených réniových katalyzátorov pri dehydrogenácii cyklohexánu Izvestiya Akademii Nauk. Chemická séria. 1996, č. 8.-S. 2119-2121.
126. Ryashentseva M.A. Selektívna dehydrogenácia izopropylalkoholu na bimetalických katalyzátoroch obsahujúcich rénium s nízkou molekulovou hmotnosťou Izvestiya Akademii Nauk. Chemická séria. 1998, č. 11. 2381-2383. 201
127. Zemskov SV, Gornostaev L.L., Mitkin V.N., Ermakov Yu.I., Lisitsyn A.S., Likholobov V.A., Kedrinsky I.A., Pogodaev V.P., Plaksin G.V., Surovikin V.F. Fluorový uhlík a spôsob jeho výroby. RF patent č. 2054375, Appl. 15.05.1987, publ. 20.02.1996 (IPC C01 B31/00).
128. Kovalenko G.A., Semikolenov V.A., Kuznetsova E.V., Plaksin G.V., Rudina N.A. Uhlíkové materiály ako adsorbenty pre biologicky aktívne látky a bakteriálne bunky Koloidný časopis. 1999, 61, č. 6. 787-795.
129. Yakerson V.I., Golosman E.Z. Katalyzátory a cementy. M.: Chémia, 1992. -256 s.
130. Nissenbaum V.D. Tvorba, povrch a katalytické vlastnosti kontaktov na báze hlinitanov vápenatých: Dis....kand. chem. vedy. Moskva, 1989.
131. Rodriguez-Reinoso F. Úloha uhlíkových materiálov v heterogénnej katalýze Uhlík. 1998, 36, č.3. S. 159-175. 166. P.A. Lýdia, B.A. Milk, L.L. Andreeva Chemické vlastnosti anorganických zlúčenín Ed. R.A. Lidina. Moskva: Chémia, 1996. 480 s.
132. Povrchová analýza Augerovou a röntgenovou fotoelektrónovou spektroskopiou: per. z angličtiny. vyd. D. Briggs a M.P. Seeha. M.: Mir, 1987.-600 s. 202
Andrey Kamensky, vedúci Katedry fyziológie na Fakulte biológie Moskovskej štátnej univerzity, hovorí, že bol vždy prekvapený, ako taká jednoduchá molekula ako etanol, ktorú astronauti objavili dokonca aj vo vesmíre, spúšťa v tele obrovské množstvo zložitých reakcií. . Túto akciu možno prirovnať k efektu padajúceho domina v dizajne, ktorý je zverejnený už niekoľko mesiacov. Je tu ale nepríjemný rozdiel – karoséria sa už nedá znova zložiť.
Alkohol je milovaný pre to, že sa môžete stať veselým, impulzívnym a odvážnym. Vedci nepopierajú, že malá stimulácia neurónov zvyšuje duševnú aktivitu vrátane myslenia. Alkohol môže tiež zlepšiť analytické schopnosti. Príliš plachý - pomoc pri komunikácii. Poľovníci – dávajte si pozor. Alkohol dokonca bojuje s cholesterolovými plakmi v cievach. Ale hovoriť o niekoľkých cnostiach alkoholu má zmysel, ak poznáte mieru. A aká je miera je tiež otázka.
Vedci tvrdia, že pôžitok z alkoholu je neprirodzený. Výskumníci sú nestranní: „Zdá sa, že alkohol prerušuje cestu k centru potešenia v našom mozgu.“ „Prirodzený“ pôžitok, ako je hudba, dobre vykonaná práca alebo sex, má dlhšiu cestu cez zložitý systém kontrol a protiváh, ktorý vyhodnocuje informácie a dávkuje odmeny. A alkohol do tohto centra jednoducho vtrhne. Dopadá to ako vo výhernej lotérii – veľká výhra pre nič. Ukazuje sa, že človek sám pomocou pre neho neznámych biochemických reakcií dosiahne určitý efekt, podobný elektrickej stimulácii mozgu na centrum rozkoše.
Po požití sa alkohol rýchlo vstrebáva do krvného obehu, najskôr v žalúdku, ale vo väčšej miere v črevách. Prvou vážnou bariérou pre účinnú látku alkoholického nápoja, ktorou je etanol, v obehovom systéme je pečeň, ktorá doslova filtruje krv.
Etanol vzniká v tele, aj keď nepijete alkohol: v dôsledku využitia škodlivého a toxického acetaldehydu enzýmami, ktorý je produktom rozkladu niektorých látok. Ale keď sa k alkoholu pridá ďalší etanol, naruší to tento vzorec. A začína reverzná reakcia: prebytok etanolu sa pod vplyvom rovnakých enzýmov čiastočne premení na acetaldehyd. Etanol aj acetaldehyd sú príliš veľa.
Keď vypijete prvý pohár, pečeň začne tvrdo pracovať: nevie, aký ste inteligentný a zdržanlivý, či sa zastavíte alebo sa opijete.
Lekári vymysleli spôsob, ako „piť skokom“ Povedzme, že máte večer nejakú udalosť – svadba, pohreb, narodeniny, kde si musíte pripiť. Pripravujete sa - vypijete pohár koňaku počas dňa a pečeň začne poháňať enzým v rezerve. A keď sa večer začnete opäť natierať, pečeň víťazoslávne hovorí svojim bunkám: ach, ako skvele, že sme pripravení! Krúžok po kruhu bude cez pečeňové filtre presakovať krv a alkohol. Zlejeme, urýchlia prácu. Ale ak príde úplne neskrotná infúzia, potom to pečeň vzdá. Potom budete cikať čistým etanolom.
(c) (úryvok z článku G. Kostinu, časopis "Expert", č. 46)
Etanol - čo je táto látka? Aké je jeho použitie a ako sa vyrába? Etanol je každému známy pod iným názvom – alkohol. Samozrejme, toto označenie nie je celkom správne. Ale medzitým pod slovom „alkohol“ máme na mysli „etanol“. O jeho existencii vedeli už aj naši predkovia. Získali ho fermentačným procesom. Používali sa rôzne produkty od obilnín po bobule. Ale vo výslednej Brage, ako sa za starých čias nazývali alkoholické nápoje, množstvo etanolu nepresiahlo 15 percent. Čistý alkohol bolo možné izolovať až po preštudovaní destilačných procesov.
Etanol - čo to je?
Etanol je jednosýtny alkohol. Za normálnych podmienok je to prchavá, bezfarebná, horľavá kvapalina so špecifickým zápachom a chuťou. Etanol našiel široké uplatnenie v priemysle, medicíne a každodennom živote. Je to výborný dezinfekčný prostriedok. Alkohol sa používa ako palivo a ako rozpúšťadlo. Ale predovšetkým vzorec etanolu C2H5OH je známy milovníkom alkoholických nápojov. Práve v tejto oblasti našla táto látka široké uplatnenie. Netreba však zabúdať, že alkohol ako účinná látka v alkoholických nápojoch pôsobí silne tlmivo. Táto psychoaktívna látka môže tlmiť centrálny nervový systém a spôsobiť silnú závislosť.
V súčasnosti je ťažké nájsť odvetvie, kde by sa etanol nepoužíval. Je ťažké vymenovať, na čo všetko je alkohol taký užitočný. Ale predovšetkým sa jeho vlastnosti oceňovali vo farmaceutikách. Etanol je hlavnou zložkou takmer všetkých liečivých tinktúr. Na tejto látke sú založené mnohé „babské recepty“ na liečbu ľudských neduhov. Čerpá všetky užitočné látky z rastlín a hromadí ich. Táto vlastnosť alkoholu našla uplatnenie pri výrobe domácich bylinných a bobuľových tinktúr. A hoci ide o alkoholické nápoje, s mierou prinášajú zdravotné benefity.
Výhody etanolu

Vzorec etanolu je známy každému už od školských hodín chémie. Ale tu je výhoda tejto chemikálie, nie každý okamžite odpovie. V skutočnosti je ťažké si predstaviť priemysel, kde by sa alkohol nepoužíval. V prvom rade sa etanol používa v medicíne ako silný dezinfekčný prostriedok. Ošetrujú operačnú plochu a rany. Alkohol má škodlivý vplyv na takmer všetky skupiny mikroorganizmov. Ale etanol sa používa nielen v chirurgii. Je nevyhnutný na výrobu liečivých extraktov a tinktúr.
V malých dávkach je alkohol pre ľudský organizmus prospešný. Pomáha riediť krv, zlepšuje krvný obeh a rozširuje cievy. Dokonca sa používa na prevenciu kardiovaskulárnych ochorení. Etanol pomáha zlepšiť fungovanie gastrointestinálneho traktu. Ale len v naozaj malých dávkach.
Vo zvláštnych prípadoch môže psychotropný účinok alkoholu prehlušiť najsilnejšie bolesti. Etanol našiel uplatnenie v kozmeteológii. Pre svoje výrazné antiseptické vlastnosti je súčasťou takmer všetkých čistiacich mliek na problematickú a mastnú pleť.
Škody spôsobené etanolom
Etanol je alkohol vyrobený fermentáciou. Pri nadmernom používaní môže spôsobiť ťažkú toxikologickú otravu až kómu. Táto látka je súčasťou alkoholických nápojov. Alkohol spôsobuje najsilnejšiu psychickú a fyzickú závislosť. Alkoholizmus sa považuje za chorobu. Škody spôsobené etanolom sú bezprostredne spojené so scénami nekontrolovateľného opilstva. Nadmerná konzumácia nápojov obsahujúcich alkohol vedie nielen k otravám jedlom. Všetko je oveľa komplikovanejšie. Pri častom pití alkoholu sú postihnuté takmer všetky orgánové systémy. Z nedostatku kyslíka, ktorý spôsobuje etanol, mozgové bunky odumierajú vo veľkom počte. Vyskytuje sa V počiatočných štádiách sa pamäť oslabuje. Vtedy sa u človeka objavia ochorenia obličiek, pečene, čriev, žalúdka, ciev a srdca. U mužov dochádza k strate potencie. V posledných štádiách alkoholika sa odhaľuje deformácia psychiky.
História alkoholu

Etanol - čo je táto látka a ako sa získala? Nie každý vie, že sa používa už od praveku. Bol súčasťou alkoholických nápojov. Pravda, jeho koncentrácia bola malá. Medzitým sa však v Číne našli na 9000 rokov starej keramike stopy alkoholu. To jasne naznačuje, že ľudia v období neolitu pili nápoje obsahujúce alkohol.
Prvý prípad bol zaznamenaný v 12. storočí v Salerne. Pravda, bola to zmes voda-alkohol. Čistý etanol izoloval Johann Tobias Lovitz v roku 1796. Použil metódu filtrácie aktívnym uhlím. Výroba etanolu touto metódou zostala dlho jedinou metódou. Vzorec pre alkohol vypočítal Nicolo-Théodore de Saussure a Antoine Lavoisier ho opísal ako uhlíkovú zlúčeninu. V 19. a 20. storočí veľa vedcov skúmalo etanol. Všetky jeho vlastnosti boli študované. V súčasnosti sa rozšíril a používa sa takmer vo všetkých sférach ľudskej činnosti.
Získavanie etanolu alkoholovou fermentáciou
Asi najznámejším spôsobom výroby etanolu je alkoholové kvasenie. Je to možné len pri použití ekologických produktov, ktoré obsahujú veľké množstvo uhľohydrátov, ako je hrozno, jablká, bobule. Ďalšou dôležitou zložkou pre aktívny priebeh fermentácie je prítomnosť kvasiniek, enzýmov a baktérií. Spracovanie zemiakov, kukurice, ryže vyzerá rovnako. Na získanie palivového liehu sa používa surový cukor, ktorý sa vyrába z trstiny. Reakcia je dosť zložitá. V dôsledku fermentácie sa získa roztok, ktorý neobsahuje viac ako 16 % etanolu. Vyššiu koncentráciu nie je možné dosiahnuť. Je to spôsobené tým, že kvasinky nie sú schopné prežiť vo viac nasýtených roztokoch. Výsledný etanol sa teda musí podrobiť procesu čistenia a koncentrácie. Zvyčajne sa používajú destilačné procesy.
Na získanie etanolu použite typ kvasiniek Saccharomyces cerevisiae rôznych kmeňov. V zásade sú všetky schopné aktivovať tento proces. Ako živný substrát možno použiť piliny alebo alternatívne roztok z nich získaný.
Palivo

Mnoho ľudí vie o vlastnostiach, ktoré má etanol. To, že ide o alkohol alebo dezinfekčný prostriedok, je tiež všeobecne známe. Ale aj alkohol je palivo. Používa sa v raketových motoroch. Známy fakt – počas prvej svetovej vojny sa ako palivo pre prvú nemeckú balistickú strelu na svete – V-2 používal 70% vodný etanol.
V súčasnosti sa alkohol rozšíril. Ako palivo sa používa v spaľovacích motoroch, pre vykurovacie zariadenia. V laboratóriách sa nalieva do liehových lámp. Katalytická oxidácia etanolu sa využíva na výrobu vyhrievacích podložiek, vojenských aj turistických. Obmedzený alkohol sa používa v zmesi s kvapalnými ropnými palivami kvôli jeho hygroskopickosti.
Etanol v chemickom priemysle
Etanol je široko používaný v chemickom priemysle. Slúži ako surovina na výrobu látok ako dietyléter, kyselina octová, chloroform, etylén, acetaldehyd, tetraetylolovo, etylacetát. V priemysle farieb a lakov sa etanol široko používa ako rozpúšťadlo. Alkohol je hlavnou zložkou ostrekovačov a nemrznúcej zmesi. Alkohol sa používa aj v domácich chemikáliách. Používa sa v pracích a čistiacich prostriedkoch. Je obzvlášť bežný ako zložka v kvapalinách na starostlivosť o inštalatérske práce a sklo.
Etylalkohol v medicíne

Etylalkohol možno pripísať antiseptikám. Má škodlivý účinok na takmer všetky skupiny mikroorganizmov. Ničí bunky baktérií a mikroskopických húb. Použitie etanolu v medicíne je takmer univerzálne. Je to vynikajúci sušiaci a dezinfekčný prostriedok. Kvôli svojim opaľovacím vlastnostiam sa alkohol (96%) používa na ošetrenie operačných stolov a rúk chirurga.
Etanol je rozpúšťadlom pre lieky. Je široko používaný na výrobu tinktúr a extraktov z liečivých bylín a iných rastlinných materiálov. Minimálna koncentrácia alkoholu v takýchto látkach nepresahuje 18 percent. Etanol sa často používa ako konzervačná látka.
Na potieranie je výborný aj etylalkohol. Počas horúčky má chladivý účinok. Veľmi často sa alkohol používa na otepľovacie obklady. Zároveň je absolútne bezpečný, na koži nie je žiadne začervenanie a popáleniny. Okrem toho sa etanol používa ako odpeňovač pri umelom dodávaní kyslíka počas pľúcnej ventilácie. Alkohol je tiež súčasťou celkovej anestézie, ktorú možno použiť v prípade nedostatku liekov.
Napodiv, ale lekársky etanol sa používa ako protijed pri otravách toxickými alkoholmi, ako je metanol alebo etylénglykol. Jeho pôsobenie je spôsobené tým, že v prítomnosti niekoľkých substrátov enzým alkoholdehydrogenáza vykonáva iba kompetitívnu oxidáciu. Je to spôsobené tým, že po bezprostrednom príjme etanolu, po toxickom metanole alebo etylénglykole, sa pozoruje zníženie súčasnej koncentrácie metabolitov otravujúcich telo. Pre metanol je to kyselina mravčia a formaldehyd a pre etylénglykol je to kyselina šťaveľová.
potravinársky priemysel
Takže, ako získať etanol, bolo známe našim predkom. No najviac sa používal až v 19. a 20. storočí. Spolu s vodou je etanol základom takmer všetkých alkoholických nápojov, predovšetkým vodky, ginu, rumu, koňaku, whisky a piva. Alkohol sa v malom množstve nachádza aj v nápojoch, ktoré sa získavajú fermentáciou, napríklad v kefíre, koumissi a kvase. Nie sú však klasifikované ako alkohol, pretože koncentrácia alkoholu v nich je veľmi nízka. Obsah etanolu v čerstvom kefíre teda nepresahuje 0,12 %. Ale ak sa usadí, potom sa koncentrácia môže zvýšiť na 1%. V kvase je o niečo viac etylalkoholu (do 1,2%). Najviac zo všetkého alkoholu je obsiahnutý v koumiss. V čerstvom mliečnom výrobku je jeho koncentrácia od 1 do 3% a v usadenom dosahuje 4,5%.
Etylalkohol je dobré rozpúšťadlo. Táto vlastnosť umožňuje jeho využitie v potravinárskom priemysle. Etanol je rozpúšťadlom pre vonné látky. Okrem toho sa dá použiť ako konzervačný prostriedok na pečivo. Je registrovaná ako potravinárska prídavná látka E1510. Etanol má energetickú hodnotu 7,1 kcal/g.
Vplyv etanolu na ľudské telo

Výroba etanolu bola zavedená po celom svete. Táto cenná látka sa používa v mnohých oblastiach ľudského života. sú liekom. Utierky napustené touto látkou sa používajú ako dezinfekčný prostriedok. Aký vplyv však má etanol na naše telo pri požití? Je to užitočné alebo škodlivé? Tieto problémy si vyžadujú podrobné štúdium. Každý vie, že ľudstvo po stáročia konzumuje alkoholické nápoje. Ale až v minulom storočí problém alkoholizmu nadobudol veľké rozmery. Naši predkovia pili maškrty, medovinu a dokonca aj dnes tak obľúbené pivo, no všetky tieto nápoje obsahovali nízke percento etanolu. Preto nemohli spôsobiť výraznú ujmu na zdraví. Ale potom, čo Dmitrij Ivanovič Mendelejev v určitých pomeroch zriedil alkohol vodou, všetko sa zmenilo.
V súčasnosti je alkoholizmus problémom takmer všetkých krajín sveta. Akonáhle je alkohol v tele, má patologický účinok na takmer všetky orgány bez výnimky. V závislosti od koncentrácie, dávky, cesty vstupu a trvania expozície môže etanol vykazovať toxické a narkotické účinky. Je schopný narušiť fungovanie kardiovaskulárneho systému, prispieva k výskytu chorôb tráviaceho traktu vrátane žalúdočných a dvanástnikových vredov. Pod narkotickým účinkom sa rozumie schopnosť alkoholu spôsobiť stupor, necitlivosť na bolesť a inhibíciu funkcií centrálneho nervového systému. Okrem toho má človek alkoholické vzrušenie, veľmi rýchlo sa stáva závislým. V niektorých prípadoch môže nadmerná konzumácia etanolu spôsobiť kómu.
Čo sa deje v našom tele, keď pijeme alkohol? Molekula etanolu je schopná poškodiť centrálny nervový systém. Pod vplyvom alkoholu sa v nucleus accumbens, u ľudí s výrazným alkoholizmom a v orbitofrontálnej kôre uvoľňuje hormón endorfín. Napriek tomu však etanol nie je uznávaný ako narkotická látka, hoci vykazuje všetky zodpovedajúce účinky. Etylalkohol nebol zaradený do medzinárodného zoznamu kontrolovaných látok. A to je kontroverzná otázka, pretože v určitých dávkach, konkrétne 12 gramov látky na 1 kilogram telesnej hmotnosti, vedie etanol najskôr k akútnej otrave a potom k smrti.
Aké choroby spôsobuje etanol?

Samotný etanolový roztok nie je karcinogén. Ale jeho hlavný metabolit, acetaldehyd, je toxická a mutagénna látka. Okrem toho má tiež karcinogénne vlastnosti a vyvoláva rozvoj rakoviny. Jeho kvality boli skúmané v laboratórnych podmienkach na pokusných zvieratách. Tieto vedecké práce viedli k veľmi zaujímavým, no zároveň alarmujúcim výsledkom. Ukazuje sa, že acetaldehyd nie je len karcinogén, môže poškodiť DNA.
Dlhodobé požívanie alkoholických nápojov môže u ľudí spôsobiť ochorenia ako gastritída, cirhóza pečene, dvanástnikový vred, rakovina žalúdka, pažeráka, pažeráka a konečníka a kardiovaskulárne ochorenia. Pravidelné požívanie etanolu v tele môže vyvolať oxidačné poškodenie mozgových neurónov. V dôsledku poškodenia umierajú. Zneužívanie nápojov obsahujúcich alkohol vedie k alkoholizmu a klinickej smrti. Ľudia, ktorí pravidelne pijú alkohol, majú vyššie riziko srdcového infarktu a mozgovej príhody.
Ale to nie sú všetky vlastnosti etanolu. Táto látka je prirodzený metabolit. V malých množstvách sa môže syntetizovať v tkanivách ľudského tela. Nazýva sa to pravda.Vyrába sa tiež v dôsledku rozkladu sacharidových potravín v gastrointestinálnom trakte. Takýto etanol sa nazýva „podmienečne endogénny alkohol“. Dokáže obyčajný alkohol tester určiť alkohol, ktorý sa v tele syntetizoval? Teoreticky je to možné. Jeho množstvo zriedka presahuje 0,18 ppm. Táto hodnota je na spodnej hranici najmodernejších meracích prístrojov.
Etylalkohol С2Н5ОН (etanol, etylalkohol, vínny alkohol) je bezfarebná, prchavá kvapalina s charakteristickým zápachom, pálivá v chuti (pl. 0,813-0,816, t.v. 77-77,5 °C). Etylalkohol horí modrastým plameňom, mieša sa vo všetkých pomeroch s vodou, dietyléterom a mnohými inými organickými rozpúšťadlami, destiluje s vodnou parou.
Etylalkohol sa získava kvasením produktov obsahujúcich škrob (obilie, zemiaky), ovocie, cukor atď. Etylalkohol získaný kvasením sa oddestiluje a získa sa surový alkohol, ktorý sa čistí rektifikáciou. Surový alkohol a mesačný svit vyrobený doma obsahujú určité množstvo fuselových olejov, ktorých zloženie a vlastnosti sú opísané nižšie (pozri kapitolu IV, § 10). Fusel oleje sa v tele metabolizujú pomerne pomaly. Preto je trvanie ich pôsobenia na telo väčšie ako u etylalkoholu.
Použitie etylalkoholu. Etylalkohol je široko používaný v priemysle ako rozpúšťadlo a východiskový produkt na výrobu mnohých chemických zlúčenín. Tento alkohol sa používa v medicíne ako dezinfekčný prostriedok.
V chemických laboratóriách sa používa ako rozpúšťadlo, je súčasťou mnohých alkoholických nápojov.
Účinky na telo a toxicita. Etylalkohol sa môže dostať do tela niekoľkými spôsobmi: požitím, intravenóznym podaním a tiež pľúcami vo forme pár s vdychovaným vzduchom.
Vstúpil do tela etylalkoholu pôsobí na mozgovú kôru. V tomto prípade dochádza k intoxikácii s charakteristickou alkoholickou "excitáciou". Táto excitácia nie je výsledkom zintenzívnenia excitačného procesu, ale vzniká oslabením procesu inhibície. Pod vplyvom alkoholu sa teda prejavuje prevaha excitačných procesov nad inhibičnými procesmi. Vo veľkých dávkach spôsobuje etylalkohol inhibíciu funkcií miechy a predĺženej miechy. V tomto prípade môže nastať stav predĺženej hlbokej anestézie so stratou reflexov a útlmom životne dôležitých centier. Pod vplyvom etylalkoholu môže dôjsť k smrti v dôsledku ochrnutia dýchacieho centra.
O toxicite etylalkoholu svedčí prítomnosť prípadov akútnej otravy týmto alkoholom. Akútna otrava etylalkoholom zaujíma v poslednom desaťročí prvé miesto (asi 60 %) medzi otravami inými toxickými látkami. Alkohol spôsobuje nielen akútnu otravu, ale prispieva aj k náhlej smrti na iné ochorenia (predovšetkým na ochorenia kardiovaskulárneho systému),
Stupeň toxicity etylalkoholu závisí od dávky, jeho koncentrácie v nápojoch, od prítomnosti tavných olejov a iných nečistôt v nich, ktoré sa pridávajú, aby nápoj získal určitú vôňu a chuť. Za približne smrteľnú dávku pre človeka sa považuje 6-8 ml čistého etylalkoholu na 1 kg telesnej hmotnosti. V prepočte na celkovú telesnú hmotnosť je to 200-300 ml etylalkoholu. Táto dávka sa však môže meniť v závislosti od citlivosti na etylalkohol, podmienok jeho príjmu (sila nápojov, plnosť žalúdka jedlom) atď. U niektorých jedincov môže smrť nastať po užití 100-150 g čistý etylalkohol, zatiaľ čo u iných osôb. smrť nenastáva ani po užití 600 – 800 g tohto alkoholu.
Dlhodobé zneužívanie etylalkoholu vedie k chronickej otrave (alkoholizmus). Opakovaný príjem alkoholu vedie k rozvoju závislosti, v dôsledku čoho malé dávky tohto alkoholu prestávajú spôsobovať predchádzajúci euforický stav. Na navodenie euforického stavu potrebujú takýto jedinci časom zvýšenú dávku etylalkoholu. Súčasne so závislosťou sa rozvíja závislosť a potom sa vyvíja závislosť od alkoholu (alkoholizmus), ktorá sa vyznačuje bolestivými zážitkami bez pitia alkoholu a silnou túžbou zopakovať jeho príjem.
V dôsledku dlhodobého užívania etylalkoholu dochádza k niekoľkým závažným poruchám telesných funkcií: cirhóza pečene, degenerácia srdcového svalu a obličiek, pretrvávajúca expanzia ciev na tvári (najmä ciev nos), svalové chvenie, halucinácie, násilné delírium (bludné tremeny), degenerácia mužských a ženských pohlavných žliaz, v dôsledku ktorej sa alkoholikom rodia deti s duševnou a telesnou nedostatočnosťou. Intoxikácia alkoholom je navyše často príčinou nehôd doma, v práci, v doprave atď. Značný počet porušení socialistickej zákonnosti a trestných činov sa pácha v opitosti.
Alkoholizmus je teda veľké spoločenské zlo, s ktorým treba rozhodne bojovať.
distribúcie v tele. Etylalkohol je nerovnomerne distribuovaný v tkanivách a telesných tekutinách. Závisí to od množstva vody v orgáne alebo biologickej tekutine. Kvantitatívny obsah etylalkoholu je priamo úmerný množstvu vody a nepriamo úmerný množstvu tukového tkaniva v tele. Telo obsahuje asi 65% vody z celkovej telesnej hmotnosti. Z tohto množstva je 75 – 85 % vody obsiahnutých v plnej krvi. Vzhľadom na veľký objem krvi v tele akumuluje oveľa väčšie množstvo etylalkoholu ako v iných orgánoch a tkanivách. Stanovenie etylalkoholu v krvi má preto veľký význam pre posúdenie množstva tohto alkoholu, ktoré sa dostalo do tela. Existuje určitý vzťah medzi množstvom etylalkoholu v krvi a moči. V prvých 1-2 hodinách po užití etylalkoholu (alkoholické nápoje) je jeho koncentrácia v moči o niečo nižšia ako v krvi. Počas obdobia eliminácie obsah etylalkoholu v moči odobratom katétrom z močovodu prevyšuje jeho obsah v krvi. Tieto údaje sú veľmi dôležité pre stanovenie času, ktorý uplynul od okamihu požitia etylalkoholu do okamihu štúdie.
Veľký význam v diagnostike intoxikácií a otravy etylalkoholom majú výsledky kvantitatívneho stanovenia tohto alkoholu, ktoré sú vyjadrené v ppm (% 0), čo znamená tisícinu.
Pri hodnotení výsledkov kvantitatívneho stanovenia etylalkoholu v krvi treba brať do úvahy, že tento alkohol môže vzniknúť pri hnilobnom rozklade mŕtvol. Pri hnilobe v krvi mŕtvol môže od zanedbateľných množstiev vzniknúť až 2,4 °/o etylalkoholu. V prvých 2-3 dňoch po smrti sa etylalkohol pod vplyvom alkoholdehydrázy do určitej miery rozkladá, ktorá si v tomto čase ešte zachováva enzymatickú aktivitu.
Na rozdiel od krvi v moči mŕtvol nedochádza k tvorbe etylalkoholu. Preto sa na posúdenie stupňa intoxikácie stanovuje etylalkohol v krvi aj v moči.
Závery o stupni intoxikácie a smrteľnej otravy etylalkoholom sa robia na základe výsledkov stanovenia tohto alkoholu v krvi. Ak sa v krvi nájde menej ako 0,3 °/oo etylalkoholu, dochádza k záveru, že tento alkohol nemá na organizmus žiadny vplyv. Ľahká intoxikácia je charakterizovaná prítomnosťou 0,5-1,5% etylalkoholu v krvi. Pri strednej intoxikácii sa v krvi nachádza 1,5-2,5% 0 a pri ťažkej intoxikácii 2,5-3,0% etylalkoholu. Pri ťažkej otrave obsahuje krv 3-5% b a pri smrteľnej otrave - 5-6% etylalkoholu.
Metabolizmus. Časť etylalkoholu (2-10°/o) sa z tela vylučuje v nezmenenej forme močom, vydychovaným vzduchom, potom, slinami, výkalmi atď. Zvyšok tohto alkoholu sa metabolizuje. Okrem toho môže metabolizmus etylalkoholu prebiehať niekoľkými spôsobmi. Určité množstvo etylalkoholu sa oxiduje za vzniku vody a oxidu uhoľnatého (IV). O niečo väčšie množstvo tohto alkoholu sa oxiduje na acetaldehyd a potom na kyselinu octovú.
Ak sa do tela dostane antabus, cyamid a niektoré ďalšie látky, dochádza k oneskoreniu premeny acetaldehydu na kyselinu octovú. To vedie k hromadeniu acetaldehydu v tele, čo spôsobuje averziu k alkoholu.
Detekcia etylalkoholu
Pri skúmaní orgánov mŕtvych tiel (žalúdok s obsahom, pečeň, obličky atď.) na prítomnosť etylalkoholu sa tento oddestiluje vodnou parou. Etylalkohol sa zisťuje pomocou reakcií opísaných nižšie. Na detekciu etylalkoholu v krvi a moči sa používa plynová kvapalinová chromatografia.
Mikrodifúzna metóda. Etylalkohol možno zistiť vyššie opísanou mikrodifúznou metódou (pozri kapitolu III, § 3).
Reakcia tvorby jódu. Keď sa etylalkohol zahrieva s roztokom jódu a alkálie, vytvorí sa jodoform (SH3), ktorý má špecifický zápach:
Vykonanie reakcie. Do skúmavky pridajte 1 ml testovacieho roztoku a 2 ml 5 % roztoku hydroxidu sodného alebo uhličitanu sodného. K tejto zmesi sa po kvapkách pridáva 1 % roztok jódu v 2 % roztoku jodidu draselného, kým sa nedosiahne mierne žlté sfarbenie. Zmes sa potom zahrieva niekoľko minút vo vodnom kúpeli (50 °C). V prítomnosti etylalkoholu je cítiť zápach jodoformu. Pri relatívne veľkých množstvách etylalkoholu sa vo vzorke tvoria kryštály jódu, ktoré majú tvar šesťuholníkov a hviezd.
Detekčný limit: 0,04 mg etylalkoholu v 1 ml roztoku. Táto reakcia nie je špecifická pre etylalkohol. Je to dané acetónom, kyselinou mliečnou atď.
esterifikačná reakcia. Octan sodný a benzoylchlorid sa používajú na esterifikáciu etylalkoholu.
1. Reakcia tvorby etylesteru kyseliny octovej. Etylalkohol s octanom sodným v prítomnosti kyseliny sírovej tvorí etylester kyseliny octovej, ktorý má charakteristický zápach:
Vykonanie reakcie. Do skúmavky sa pridá 1 ml testovacieho roztoku a 0,1 g vysušeného octanu sodného, potom sa opatrne po kvapkách pridajú 2 ml koncentrovanej kyseliny sírovej. Zmes sa zahrieva na plameni horáka (skúmavku je lepšie nahrievať v parafínovom alebo glycerínovom kúpeli), kým sa neuvoľnia bublinky plynu. Výskyt špecifického zápachu etylacetátu indikuje prítomnosť etylalkoholu v testovanom roztoku.
Detekčný limit: 15 µg etylalkoholu v 1 ml roztoku.
Vôňa aceto-etyléteru je zreteľnejšia, ak sa obsah skúmavky naleje do 20-25-násobku objemu vody.
2. Reakcia tvorby etylbenzoátu. Keď etylalkohol reaguje s benzoylchloridom (benzoylchlorid), vzniká etylbenzoát, ktorý má charakteristický zápach:
Rozpoznaniu zápachu etylbenzoátu bráni nadbytok benzoylchloridu, ktorý nepríjemne zapácha. Preto sa na rozklad nadbytku benzoylchloridu pridáva alkalický roztok:
Vykonanie reakcie. Do 1 ml testovaného roztoku pridajte 1-2 kvapky benzoylchloridu. Za častého miešania sa do zmesi po kvapkách pridáva 10 % roztok hydroxidu sodného, kým nezmizne dusivý zápach benzoylchloridu. Výskyt zápachu etylbenzoátu naznačuje prítomnosť etylalkoholu vo vzorke. Táto vôňa je lepšia, cítiť po nanesení niekoľkých kvapiek reakčnej zmesi na kúsok filtračného papiera. Reakcii bráni metylalkohol, pretože vôňa etylbenzoátu pripomína vôňu metyléteru kyseliny benzoovej.
Reakcia tvorby acetaldehydu. Etylalkohol sa oxiduje dvojchrómanom draselným, manganistanom draselným a niektorými ďalšími oxidačnými činidlami na acetaldehyd:
Vykonanie reakcie. K 1 ml skúšobného roztoku sa pridáva 10 % roztok kyseliny sírovej, kým sa nezíska kyslé prostredie (podľa lakmusu), k tejto zmesi sa po kvapkách pridáva 10 % roztok dvojchrómanu draselného, kým kvapalina nezíska oranžovočervenú farbu. Zmes sa nechá niekoľko minút pri teplote miestnosti. V prítomnosti etylalkoholu v testovacom roztoku sa objaví zápach acetaldehydu. Táto reakcia môže tiež produkovať určité množstvo kyseliny octovej. Vedľajšia reakcia tvorby kyseliny octovej znižuje citlivosť detekčnej reakcie acetaldehydu.
Oxidácia etylalkoholu a jej detekcia acetaldehydom. Acetaldehyd, ktorý vzniká pri oxidácii etanolu, možno detegovať reakciou s nitroprusidom sodným a morfolínom. Na tento účel sa na odkvapkávaciu doštičku alebo filtračný papier nanesú 2-3 kvapky roztoku4 obsahujúceho acetaldehyd a pridá sa kvapka činidla (čerstvo pripravená zmes rovnakých objemov 20 % vodného roztoku morfolínu a 5 % vodného roztok nitroprusidu sodného). V prítomnosti acetaldehydu sa v roztoku objaví modré sfarbenie.
Detekčný limit: 1 µg acetaldehydu na vzorku.
Táto reakcia je daná akroleínom a niektorými ďalšími aldehydmi. Reakciou s morfolínom a nitroprusidom sodným vzniká propiónaldehyd len vo vysokých koncentráciách. Formaldehyd túto reakciu nespôsobuje. Preto možno na rozlíšenie metylalkoholov a etylalkoholov použiť oxidačnú reakciu etylalkoholu na acetaldehyd a jeho detekciu pomocou morfolínu a nitroprusidu sodného.
Predbežný test na prítomnosť etylalkoholu v moči a krvi. Tento test je podrobne opísaný vyššie (pozri kapitolu IV, § 8).
Detekcia etylalkoholu v nápojoch a roztokoch plynovo-kvapalinovou chromatografiou
Princíp detekcie chemických zlúčenín metódou plyno-kvapalinovej chromatografie je opísaný v množstve literárnych zdrojov. Na detekciu etylalkoholu v roztokoch, nápojoch a iných kvapalinách plynovo-kvapalinovou chromatografiou sa ako referenčná látka používa 95 % etylalkohol. Pred zavedením do dávkovača plynového chromatografu sa tento alkohol premení na prchavejšiu zlúčeninu ako etylalkohol (bod varu 78 °C), zlúčeninou je etylnitrit (teplota varu 17 °C). Na tento účel sa do etylalkoholu pridá dusitan sodný alebo draselný a kyselina trichlóroctová:
Výsledný etyldusitan, ktorý je nad kvapalinou v plynnom stave, sa zavedie do plynového chromatografu a vykoná sa chromatografia.
Chromatografické podmienky:
chromatograf vybavený katharometrom;
kovový stĺp 100 cm dlhý, 0,6 cm v priemere;
pevný nosič: sférochróm, hesasorb alebo iné nosiče;
stacionárna kvapalná fáza: polyetylénglykol (mol. hmotnosť 1000-1500) nanesený na pevnom nosiči v množstve 12 %;
teplota termostatov kolóny a detektora je 75 °С, teplota dávkovača je izbová;
nosný plyn: technický dusík prechádzajúci cez chromatograf rýchlosťou 50-60 ml/min;
prúd detektora 60-100 mA;
rýchlosť pásky grafu 720 mm/h.
Metóda detekcie etylalkoholu v nápojoch a roztokoch. Do liekovky s penicilínom sa pridá 0,5 ml 50 % roztoku kyseliny trichlóroctovej a 0,5 ml vodného roztoku referenčnej látky (95 % etylalkohol zriedený vodou tak, aby jeho koncentrácia bola 3 – 4 % o). Fľaša je uzavretá gumovou zátkou, ktorá je upevnená špeciálnym zariadením (svorkou). Potom sa pomocou injekčnej striekačky cez gumenú zátku vstrekne do injekčnej liekovky 0,25 ml 30 % roztoku dusitanu sodného. Obsah liekovky sa dobre pretrepáva 1 minútu a pomocou ďalšej suchej striekačky sa zachytia 3 ml plynnej fázy nad kvapalinou. Táto plynná fáza obsahujúca etylnitrit sa zavedie do dávkovača chromatografu a podrobí sa chromatografii. Pri zaznamenávaní retenčného času etylnitritu.
Po dokončení chromatografie referenčnej látky sa presne rovnaký experiment vykoná so skúšobným roztokom, v ktorom sa predpokladá prítomnosť etylalkoholu.
Zhoda retenčného času látky v oboch vzorkách (vo vzorke s referenčnou a testovanou látkou) naznačuje identitu týchto látok.
Metóda detekcie etylalkoholu v krvi a moči. Metóda zisťovania etylalkoholu v krvi a moči je podobná metóde zisťovania tohto alkoholu v nápojoch a roztokoch. Najprv sa vykoná chromatografia a stanoví sa retenčný čas etylalkoholu, ktorý je referenčnou látkou. Toto stanovenie sa vykonáva tak, ako je uvedené v opise metódy stanovenia tohto alkoholu v nápojoch a roztokoch. Potom prejdite na stanovenie etylalkoholu v krvi alebo moči.
Do liekovky s penicilínom sa pridá 0,5 ml testovanej krvi alebo moču a 0,5 ml 50 % roztoku kyseliny trichlóroctovej. Fľaša je uzavretá gumovou zátkou, ktorá je upevnená špeciálnym fixátorom. Potom sa 0,25 ml 30 % roztoku dusitanu sodného vstrekne do injekčnej liekovky cez gumenú zátku pomocou injekčnej striekačky. Obsah injekčnej liekovky sa jednu minútu dobre pretrepáva. Potom sa z liekovky pomocou ďalšej injekčnej striekačky odoberú 3 ml plynnej fázy, ktorá sa vstrekne do dávkovača chromatografu a podrobí sa chromatografii. Ak sa retenčný čas referenčnej látky a látky obsiahnutej v krvi alebo moči zhodujú, urobí sa záver o prítomnosti etylalkoholu v študovaných biologických tekutinách.
Pri zistení etylalkoholu v moči alebo krvi sa na kvantifikáciu tohto alkoholu v týchto objektoch používa plynovo-kvapalinová chromatografia.
Kvantitatívne stanovenie etylalkoholu v krvi a moči plynovo-kvapalinovou chromatografiou
Na kvantitatívne stanovenie etylalkoholu v krvi a moči sa používa metóda vnútorného štandardu ako jedna z metód plyno-kvapalinovej chromatografie. Podľa tejto metódy sa do krvi alebo moču pridáva vnútorný štandard, v ktorom sa stanovuje kvantitatívny obsah etylalkoholu. Ako vnútorný štandard sa používa propylalkohol. Etylalkohol obsiahnutý v krvi alebo moči (bod varu 78 °C), ako aj propylalkohol (teplota varu 97,5 °C), pridaný ako vnútorný štandard, sa premieňajú na prchavejšie zlúčeniny (na etyldusitan s t. bp 17 °C). a propylnitrit 46-48 °C). Zmes etylnitritu a propylnitritu sa zavedie do dávkovača chromatografu a uskutoční sa chromatografia. V tomto prípade sú na chromatograme zapísané dva píky, z ktorých jeden zodpovedá etylalkoholu (etylnitritu) a druhý propylalkoholu (propylnitrit). Potom sa vypočíta pomer plochy alebo výšky píku etylalkoholu (etylnitritu) k ploche alebo výške píku vnútorného štandardu - propylalkoholu (propylnitritu).
Výpočet kvantitatívneho obsahu etylalkoholu v krvi alebo moči sa vykonáva podľa kalibračnej krivky.
Zostrojenie kalibračného grafu. Najprv pripravte sériu štandardných roztokov obsahujúcich 2, 3, 4 a 5 % etanolu a vnútorný štandardný roztok obsahujúci 4 % 0. propylalkohol. Do niekoľkých liekoviek penicilínu sa pridajú 2 ml roztoku obsahujúceho 4% 0 propylalkoholu. Do každej liekovky sa pridajú 2 ml roztoku etylalkoholu rôznych koncentrácií (2, 3, 4 a 5 % o). Obsah liekoviek sa dobre premieša a potom sa z každej liekovky odoberie 1 ml zmesi alkoholov a prenesie sa do iných liekoviek s penicilínom. Do každej injekčnej liekovky pridajte 0,5 ml 50°/o-tého roztoku kyseliny trichlóroctovej. Injekčné liekovky sú uzavreté gumovými zátkami, ktoré sú upevnené svorkami. Potom sa pomocou injekčnej striekačky cez gumovú zátku zavedie do liekoviek 0,25 ml 30 % roztoku dusitanu sodného. Obsah liekoviek sa pretrepáva jednu minútu. Potom sa pomocou ďalšej suchej injekčnej striekačky odoberú z liekoviek 3 ml
Plynná fáza, ktorá sa zavedie do dávkovača chromatografu a podrobí sa chromatografii.
Chromatografické podmienky sú uvedené vyššie v popise metódy detekcie etylalkoholu v nápojoch a roztokoch.
Chromatogramy merajú plochu alebo výšku každého píku. Potom nájdite pomer plochy alebo výšky píku etylalkoholu (etylnitritu) k ploche alebo výške píku vnútorného štandardu (propylnitrit). Berúc do úvahy, že v tomto prípade pre rôzne koncentrácie etanolu sa získajú hodnoty, ktoré sa od seba mierne líšia, vynásobia sa 100 a výsledky násobenia sa vynesú na os y kalibračného grafu. Na úsečku kalibračného grafu uveďte hodnotu koncentrácie etylalkoholu (v ° / oo).
Stanovenie etylalkoholu v krvi a moči. Do liekovky s penicilínom sa pridajú 2 ml roztoku vnútorného štandardu (propylalkohol, ktorého koncentrácia je 4 %), pridajú sa 2 ml krvi alebo moču na vyšetrenie na prítomnosť etylalkoholu. Obsah liekovky sa dobre pretrepe a potom sa 1 ml tekutiny (zmes krvi alebo moču s vnútorným štandardom) prenesie do inej liekovky od penicilínu a pridá sa 0,5 ml 50% roztoku kyseliny trichlóroctovej. Fľaša je uzavretá gumovou zátkou, ktorá je upevnená fixátorom. Pomocou injekčnej striekačky sa do injekčnej liekovky cez zátku zavedie 0,25 ml 30 % roztoku dusitanu sodného. Obsah injekčnej liekovky sa pretrepáva jednu minútu. Potom sa pomocou ďalšej suchej injekčnej striekačky z liekovky odoberú 3 ml plynnej fázy, ktorá sa prenesie do dávkovača chromatografu a uskutoční sa chromatografia.
Plochy alebo výšky píkov sa stanovia na chromatograme a vypočíta sa pomer plochy alebo výšky píku etanolu k ploche alebo výške píku vnútorného štandardu. Na základe tohto pomeru vynásobeného 100 sa z kalibračnej krivky vypočíta obsah etanolu v krvi alebo moči (v %).
Pri stanovení etylalkoholu v krvi sa koncentrácia tohto alkoholu zistená z kalibračnej krivky vynásobí 0,95 a koncentrácia etylalkoholu zistená v moči sa vynásobí 1,05.