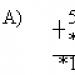Tűzzük ki magunknak a feladatot: a gázmolekulák mozgásáról és kölcsönhatásáról leegyszerűsített elképzelésekkel fejezzük ki a gáznyomást a molekulát jellemző mennyiségekkel.
Tekintsünk egy sugarú és térfogatú gömbtérfogatba zárt gázt Ha eltekintünk a gázmolekulák ütközésétől, minden molekulára elfogadhatjuk a következő egyszerű mozgássémát.
A molekula egyenes vonalban mozog és meghatározott sebességgel egyenletesen ütközik az érfalnak és a beesési szöggel megegyező szögben visszapattan onnan (83. ábra). Minden azonos hosszúságú húrt áthaladva a molekula 1 s alatt nekiütközik az ér falának. Minden egyes becsapódáskor a molekula lendülete %-kal változik (lásd 57. oldal). Az impulzus változása 1 másodpercig egyenlő lesz

Látjuk, hogy a beesési szög csökkent. Ha a molekula hegyes szögben esik a falra, akkor az ütközések gyakoriak, de gyengék; 90°-hoz közeli szögben eséskor a molekula ritkábban, de erősebben ütközik a falnak.
Az impulzus változása a molekulának a falra való minden egyes ütközésekor hozzájárul a gáz össznyomási erejéhez. Feltételezhető a mechanika alaptörvényének megfelelően, hogy a nyomáserő semmi
kivéve az összes molekula lendületének egy másodperc alatt bekövetkező változását: vagy az állandó tagot zárójelből kivéve,
Ha a gáz tartalmaz molekulákat, akkor figyelembe vehetjük a molekula sebességének középnégyzetét, amelyet a képlet határoz meg
![]()
A nyomóerő kifejezése most röviden le van írva:
A gáznyomást úgy kapjuk meg, hogy az erőkifejezést elosztjuk a kapott gömb területével
Lecserélve a következő érdekes képletet kapjuk:
Tehát a gáznyomás arányos a gázmolekulák számával és a gázmolekula transzlációs mozgásának kinetikus energiájának átlagos értékével.
A legfontosabb következtetésre jutunk, ha a kapott egyenletet összevetjük a gáz halmazállapot egyenletével. Az egyenlőségek jobb oldalának összehasonlítása azt mutatja
azaz a molekulák transzlációs mozgásának átlagos kinetikai energiája csak az abszolút hőmérséklettől függ, sőt azzal egyenesen arányos.
A levont következtetés azt mutatja, hogy a gázhalmazállapot törvényének engedelmeskedő gázok ideálisak abban az értelemben, hogy megközelítik az olyan részecskék halmazának ideális modelljét, amelyek kölcsönhatása nem lényeges. Ezen túlmenően ez a következtetés azt mutatja, hogy az abszolút hőmérsékletnek mint egy ritkított gáz nyomásával arányos mennyiségnek empirikusan bevezetett fogalmának egyszerű molekuláris kinetikai jelentése van. Az abszolút hőmérséklet arányos a molekulák transzlációs mozgásának kinetikai energiájával. az Avogadro-szám - a molekulák száma egy gramm-molekulában, ez egy univerzális állandó: A reciprok egyenlő lesz a hidrogénatom tömegével:
![]()
Az érték is egyetemes
Ezt Boltzmann-állandónak nevezik akkor
![]()
Ha a sebesség négyzetét a komponensek négyzeteinek összegén keresztül ábrázoljuk, akkor nyilvánvaló, hogy bármelyik komponensnek lesz átlagos energiája
Ezt a mennyiséget szabadsági fokonkénti energiának nevezzük.
Az univerzális gázállandó a gázokkal végzett kísérletekből jól ismert. Az Avogadro-szám vagy a Boltzmann-állandó meghatározása (egymásban kifejezve) viszonylag nehéz, kényes méréseket igénylő feladat.
Ez a levezetés hasznos képleteket bocsát rendelkezésünkre, amelyek segítségével kiszámíthatjuk a molekulák átlagos sebességét és az egységnyi térfogatra jutó molekulák számát.
Tehát a sebesség átlagos négyzetére azt kapjuk
Ez egy nem létező gáz fizikai modellje, amely nagyszámú molekulából áll, amelyek méretei elhanyagolhatóak a köztük lévő átlagos távolságokhoz képest. Egy ilyen gáz molekulái anyagi pontoknak tekinthetők, ami azt jelenti, hogy a forgási és rezgési mozgásukat nem veszik figyelembe. A molekulák mozgása más molekulákkal való ütközés nélkül történik, betartja Newton törvényeit. A molekulák ütközései az érfalakkal abszolút rugalmasak.
A gázállapot paraméterei
Nyomás, hőmérséklet és térfogat - gázállapot-paraméterek. Vagy makróparamétereknek hívják. A hőmérséklet a gázrészecskék sebességének külső jellemzője. A nyomás a falakkal való ütközés külső jellemzője, például egy edény. A térfogat az a hely, ahol a gázrészecskék be vannak zárva. A gáz az általa biztosított teljes térfogatot elfoglalja. Vannak külső paraméterek is, például testek vagy mezők, amelyek kívülről hatnak a gázra.
A gáz mikroparaméterei (kis, belső jellemzői) olyan paraméterek, amelyeket speciális kísérletek nélkül nem tudunk megbecsülni, például az egyes gázmolekulák sebességét és mozgási irányát.
Egy termodinamikai rendszernek azt az állapotát nevezzük, amikor állandó külső feltételek mellett minden paramétere nem változik az időben kiegyensúlyozott.
A molekuláris kinetikai elmélet alapegyenlete
Az egyenlet összekapcsolja az ideális gáz mikroparamétereit és makroparamétereit (nyomás, térfogat és hőmérséklet).
Tekintsünk egy ideális gázt egy köbös edényben. Mindegyik molekula rugalmasan ütközik az edény falával, és lendülete megváltozik. Az összes molekulának a falnak való ütközése makroszinten úgy érzékelhető, mint a gáz nyomása az edényre. A képletek átlagértékeket fognak tartalmazni, mert egyes molekulák gyorsabban, mások lassabban mozognak, a hozzávetőleges sebesség becsléséhez átlagértékeket veszünk.
Az MKt alapegyenlete alakja


Átlagos négyzet sebesség molekulák


Négyzetes átlagsebesség v kv A molekulák a sebesség középnégyzetének négyzetgyöke

Átlagos mozgási energia molekulák


Képleteket származtathat


Hőfok
Ez egy makroparaméter, amely a testek hőátadó képességét jellemzi. Ha két különböző hőmérsékletű test érintkezik, akkor energia- vagy hőátadás történik melegebbről hidegebbre. Letelepedett termikus egyensúly, minden alkatrész azonos hőmérsékletű lesz.
Leggyakrabban ismételt kérdések
Lehet-e pecsétet készíteni egy dokumentumra a mellékelt minta szerint? Válasz Igen, lehetséges. Szkennelt másolatot vagy jó minőségű fényképet küldjön e-mail címünkre, és mi elkészítjük a szükséges másolatot.
Milyen fizetési módokat fogad el?
Válasz Az okmányt a futár általi átvételkor fizetheti ki, miután ellenőrizte a kitöltés helyességét és az oklevél minőségét. Ez megtehető az utánvétes postai társaságok irodáiban is.
A dokumentumok szállításának és fizetésének minden feltétele a „Fizetés és kézbesítés” részben található. Szintén készek vagyunk meghallgatni javaslataikat a dokumentum szállítási és fizetési feltételeivel kapcsolatban.
Biztos lehetek benne, hogy a rendelés leadása után nem fog eltűnni a pénzemmel? Válasz Nagy tapasztalattal rendelkezünk az oklevélkészítés területén. Számos oldalunk van, amelyeket folyamatosan frissítünk. Szakembereink az ország különböző pontjain dolgoznak, naponta több mint 10 dokumentumot készítenek. Az évek során dokumentumaink sok embernek segítettek megoldani a foglalkoztatási problémákat, vagy magasabb fizetésű munkákra váltani. Bizalmat és elismerést vívtunk ki az ügyfelek körében, így erre semmi okunk. Sőt, fizikailag egyszerűen lehetetlen megtenni: a rendelést akkor fizeted, amikor kézhez kapod, nincs előleg.
Bármelyik egyetemről rendelhetek diplomát? Válasz Általában igen. Közel 12 éve dolgozunk ezen a területen. Ezalatt az ország szinte valamennyi egyeteme által kiadott dokumentumokról és a különböző kiadási évekre vonatkozóan szinte teljes adatbázis alakult ki. Mindössze egyetemet, szakot, dokumentumot kell választania, és egy megrendelőlapot kell kitöltenie.
Mi a teendő, ha elírási hibákat találok egy dokumentumban?
Válasz Ha futárunktól vagy postai cégünktől dokumentumot kap, javasoljuk, hogy alaposan ellenőrizze az összes részletet. Elírási hiba, pontatlanság észlelése esetén jogában áll az oklevelet nem átvenni, és a talált hiányosságokat személyesen vagy írásban, e-mailben jelezni kell a futárnak.
A lehető legrövidebb időn belül kijavítjuk a dokumentumot és újra elküldjük a megadott címre. A szállítást természetesen cégünk állja.
Az ilyen félreértések elkerülése érdekében az eredeti űrlap kitöltése előtt elküldjük a leendő dokumentum elrendezését az ügyfél postájára ellenőrzésre és a végleges verzió jóváhagyására. A dokumentum futárral vagy postai úton történő elküldése előtt egy további fotót és videót is készítünk (beleértve ultraibolya fényben is), hogy vizuális elképzelése legyen arról, mit kap a végén.
Mit kell tenned ahhoz, hogy diplomát rendelj a cégedtől?
Válasz Dokumentum (bizonyítvány, oklevél, tanulmányi bizonyítvány stb.) megrendeléséhez ki kell töltenie egy online megrendelőlapot a weboldalunkon, vagy meg kell adnia e-mail címét, hogy elküldjük Önnek a kérdőívet, amelyet kitöltve és el kell küldenie. vissza hozzánk.
Ha nem tudja, mit kell feltüntetni a megrendelőlap/kérdőív bármely mezőjében, hagyja üresen. Ezért minden hiányzó információt telefonon pontosítunk.
Legfrissebb értékelések
Győztes:
Nagyon elégedett vagyok a diplomámmal. Köszönöm. Ha még megtanulná az útlevélkészítést, az ideális lenne.
Karina:
Ma átvettem a diplomámat. Köszönöm a minőségi munkát. Minden határidőt betartottak. Határozottan ajánlani foglak minden barátomnak.
=
Ahol  \u003d 0,001 kg / mol - a hidrogén moláris tömege. Ezért
\u003d 0,001 kg / mol - a hidrogén moláris tömege. Ezért
 =
=
2.4.2. Határozza meg egy levegőmolekula transzlációs mozgásának átlagos kinetikus energiáját normál körülmények között! A molekulák koncentrációja normál körülmények között n 0 \u003d 2,7 * 10 25 m -3
Elemzés és döntés. A gázok molekuláris - kinetikai elméletének alapegyenletéből

 J
J
2.4.3. Keresse meg az átlagos kinetikus energiát
Elemzés és döntés.
Ismeretes, hogy a gázmolekulák minden szabadsági foka azonos átlagos energiával rendelkezik, a képlettel kifejezve

ahol k a Boltzmann-állandó, T a gáz abszolút hőmérséklete.
Mivel egy kétatomos molekula forgó mozgásának két szabadságfokot tulajdonítanak (az oxigénmolekula kétatomos), az oxigénmolekula forgómozgásának átlagos energiáját a képlet fejezi ki

Figyelembe véve, hogy k = 1,38 * 10 -23 J / K és T = 350 K, azt kapjuk, hogy
Minden gázmolekula forgómozgásának kinetikus energiáját az egyenlőség határozza meg
w =
Az összes gázmolekula száma kiszámítható a képlettel
N = N A (2)
ahol N A az Avogadro-szám, a gáz kilomoljainak száma.
Figyelembe véve, hogy a kilomolok száma 
ahol m a gáz tömege,  egy kilomol gáz tömege, akkor a (2) képlet N = N A alakot vesz fel
egy kilomol gáz tömege, akkor a (2) képlet N = N A alakot vesz fel 
Ha ezt a kifejezést N-re behelyettesítjük az (1) képletbe, megkapjuk
w = N A 
A képletben szereplő mennyiségeket fejezzük ki SI-egységben, és helyettesítsük be a (3) képletbe:
2.4.4. Számítsa ki a fajlagos hőkapacitásokat állandó térfogatú C V és állandó neon- és hidrogénnyomás mellett, ezeket a gázokat ideálisnak tekintve!
Elemzés és döntés.
Az ideális gázok fajlagos hőkapacitását a következő képletekkel fejezzük ki:
V =-vel  (1)
(1)
C p =  (2)
(2)
ahol i egy gázmolekula szabadságfokainak száma,  - moláris tömeg.
- moláris tömeg.
A neon (monatomi gáz) esetében i = 3 és  \u003d 20 * 10 -3 kg / mol.
\u003d 20 * 10 -3 kg / mol.
Az (1) és (2) képlet alapján számolva a következőt kapjuk: С V =  J/kg*k
J/kg*k
C p = 
 J/kg*k
J/kg*k
Hidrogénnél (kétatomos gáznál) i = 3 és  \u003d 2 * 10 -3 kg / mol. Ugyanezen képletekkel számolva a következőket kapjuk:
\u003d 2 * 10 -3 kg / mol. Ugyanezen képletekkel számolva a következőket kapjuk:
V =-vel  J/kg*k
J/kg*k
C p = 
 J/kg*k
J/kg*k
2.4.5. Határozza meg a hélium- és nitrogénmolekulák átlagos kinetikus energiáját, a transzlációs mozgás átlagos kinetikus energiáját t = 27 0 C hőmérsékleten. Határozza meg a 100 g-os molekulák összenergiáját. a gázokat.
Elemzés és döntés.
Bármely gáz egy molekulájának transzlációs mozgásának átlagos kinetikus energiáját egyértelműen meghatározza annak termodinamikai hőmérséklete:
 (1)
(1)
ahol k \u003d 1,38 * 10 -23 J / K - Boltzmann-állandó.
A gázmolekulák átlagos négyzetsebessége azonban molekulái tömegétől függ:
 (2)
(2)
ahol m 0 egy molekula tömege.
Egy molekula átlagos összenergiája nemcsak a hőmérséklettől függ, hanem a molekulák szerkezetétől is, azaz a szabadsági fokok számától:
Az összes molekula teljes kinetikus energiája, amely megegyezik egy ideális gáz belső energiájával, megtalálható szorzatként
Nyilvánvaló, hogy N = N А m/  (5)
(5)
ahol m a teljes gáz tömege, az m/ arány  meghatározza a mólok számát, N A pedig Avogadro-állandó. A (4) kifejezés, figyelembe véve a Clapeyron-Mendeleev egyenletet, lehetővé teszi számunkra, hogy kiszámítsuk az összes gázmolekula összenergiáját.
meghatározza a mólok számát, N A pedig Avogadro-állandó. A (4) kifejezés, figyelembe véve a Clapeyron-Mendeleev egyenletet, lehetővé teszi számunkra, hogy kiszámítsuk az összes gázmolekula összenergiáját.
Az egyenlőség szerint (1)< W о п >\u003d 6,2 * 10 -21 J, és egy molekula, valamint a hélium és a nitrogén transzlációs mozgásának átlagos energiája megegyezik.
A négyzetgyökértéket a képlet határozza meg
 , ahol R \u003d 8,31 J / k mol
, ahol R \u003d 8,31 J / k mol
Hélium esetén V kv \u003d 13,7 * 10 2 m / s
Nitrogén esetén V kv \u003d 5,17 * 10 2 m/s
A hélium egyatomos gáz, tehát i = 3< W о п >\u003d W o \u003d 6,2 * 10 -21 J.
A nitrogén kétatomos gáz, ezért i = 5 és< W о п >\u003d 5/2 kT \u003d 10,4 * 10 -21 J.
Az összes molekula összenergiája, miután a (3) és (5) kifejezéseket (4)-be cseréltük
W = kT  =
=

Héliumnál W = 93,5 kJ, nitrogénnél W = 22,3 kJ.
Példák problémamegoldásra. 1.3.1. Egyes gázmolekulák négyzetes középsebessége 450 m/s
1.3.1. Egyes gázok molekuláinak négyzetes középsebessége 450 m/s. Gáznyomás 50 kPa. Határozza meg a gáz sűrűségét ilyen körülmények között!
Megoldás. A gázmolekulák négyzetes középsebessége összefüggésben van a hőmérsékletével
ahol R az univerzális gázállandó;
m a gáz molekulatömege;
T a gáz abszolút hőmérséklete.
A gáz hőmérsékletének meghatározásához a Mengyelejev-Clapeyron egyenletet használjuk


ahol r=m/V a gáz sűrűsége.
Ennélfogva
![]() .
.

A számértékeket behelyettesítve megkaptuk

1.3.2. Határozza meg a levegőmolekulák átlagos szabad útját normál körülmények között. A levegőmolekulák effektív átmérője s=0,3 nm.
Megoldás. A gázmolekulák átlagos szabad útja
 ,
,
Ahol
s a molekula effektív átmérője;
n az egységnyi térfogatra jutó molekulák száma (molekulák koncentrációja). Az egységnyi térfogatra jutó molekulák számának meghatározásához a nyomás molekuláris-kinetikai elméletének alapegyenletét használjuk.
ahol k a Boltzmann-állandó;
T a gáz hőmérséklete.
Aztán az átlagos szabad ösvényre
 .
.
A számértékeket behelyettesítve végül a következőt kapjuk:
 m.
m.
1.3.3. Határozza meg a szén-dioxid molekulák átlagos ütközési számát egységnyi idő alatt 100 o C hőmérsékleten, ha az átlagos szabad út
Megoldás. A gázmolekulák egységnyi idő alatti ütközésének számát a reláció az átlagos szabad úthoz viszonyítja
 ,
,
Ahol  a számtani középsebesség.
a számtani középsebesség.
Ennélfogva,

Helyettesítjük a rendelkezésünkre álló számértékeket
1.3.4. Bizonyos nyomáson és hőmérsékleten 0 o Az oxigénmolekulák átlagos szabad útjával 95 nm. Határozza meg az oxigénmolekulák időegységenkénti ütközésének átlagos számát, ha az oxigénnyomás 100-szorosára csökken.
Megoldás. Az ütközések átlagos száma egységnyi idő alatt
 ,
,
Ahol
Amikor a gáznyomás változik, az átlagos szabad utak fordítottan arányosak a nyomással:
 ,
,
ahol l 1, l 2 - a gázmolekulák átlagos szabad útja a megfelelő p 1 és p 2 nyomáson.
A mi esetünkben:

Számértékek helyettesítése a
1.3.5. Az oxigénmolekulák melyik részének sebessége t=0 o С-on 100-110 m/s?
Megoldás. A molekulák sebességeloszlása a Maxwell-törvény alapján határozható meg
 ,
,
ahol u=v/v in – relatív sebesség;
v a megadott sebesség;
v in =(2RT/m) 1/2 a molekulák legvalószínűbb sebessége;
Du a relatív sebességek intervalluma, kicsi az u sebességhez képest.
Ezután a molekulák kívánt része, amelyet meg kell határozni (a molekulák sebesség szerinti eloszlása)

Esetünkben v=100 m/s; v=10 m/s; A legvalószínűbb sebesség v=(2RT/pm) 1/2 =376 m/s. Ezért u=v/v =100/376-ban, u 2 =0,071; Du=10/376; exp(-u2)=0,93.
Így az oxigénmolekulák száma, amelyek sebessége a megadott intervallumon belül van, a molekulák teljes számának 4%-a.
1.3.6. A gázt tartalmazó edény v o sebességgel mozog, majd gyorsan leáll. Mennyivel növekszik a gázmolekulák hőmozgási sebességének átlagos négyzete a következő esetekben: egyatomos gáz? Kétatomos gáz? Tekintsük a gázt ideálisnak.
Megoldás. Használjuk az energiamegmaradás törvényét. Legyen M az edényben lévő gáz tömege. V sebességgel haladva a gáz egészének mozgási energiája van
W - =Mv o 2 /2.
Ez a képlet határozza meg azon molekulák irányított mozgásának kinetikus energiáját, amelyben az edénnyel együtt részt vesznek. Az edény leállása után a molekulák irányított mozgása az edény falával való ütközés következtében hamarosan kaotikussá válik.
Ha figyelmen kívül hagyjuk a gáz és az edény falai közötti hőcserét a vizsgált időintervallumban, a gáz elszigetelt rendszernek tekinthető. Ekkor az energiamegmaradás törvényéből következik, hogy a W molekulák irányított mozgásának „eltűnt” kinetikus energiájának meg kell egyeznie a molekulák kaotikus mozgásának energianövekedésével (a DU belső energia növekedésével:
Határozzuk meg a gáz belső energiáját. Ideális egyatomos gáz esetén ez a molekulák transzlációs kaotikus mozgásának energiája:

ahol m a molekula tömege;
N az edényben lévő molekulák száma.

Ebből következik, hogy egy monoatomos gáz belső energiájának változása lassítás közben
DU \u003d U 2 -U 1 \u003d M / 2,
ahol v kv1 , v kv2 a gázmolekulák négyzetes középsebességei a lassulás elején, illetve végén.
A W to =DU egyenletben W to és DU értékeit behelyettesítve megkapjuk az első választ
v 2 sq2 -v 2 sq1 \u003d v 2 o.
Az ideális kétatomos gáz belső energiája a molekulák transzlációs és forgómozgásának energiáinak összege. Ebben az esetben három szabadsági fok esik a transzlációs mozgásra és kettő a forgásra. Az energia szabadsági fokok közötti egyenletes eloszlásának törvényével összhangban a W kinetikus energia háromötöde a molekulák transzlációs mozgásának energiájának növelésére, kétötöde pedig a forgási mozgásuk energiájának növelésére fog menni. Így most megvan

Hol kapjuk a második választ:
1.3.7. A hidrogénmolekulák melyik részének T hőmérsékleten van olyan sebessége, amely legfeljebb 5,0 m/s-ban tér el a legvalószínűbb sebességtől? Oldja meg a feladatot két T értékre: 1) 400 K, 2) 900 K.
Megoldás. A molekulák sebesség szerinti eloszlását a Maxwell-törvény fejezi ki: azon DN molekulák száma, amelyek relatív sebessége u és u + Du tartományba esik:
![]()
ahol N a gázmolekulák teljes száma;
a Maxwell eloszlásfüggvény;
u=v/v in – relatív sebesség;
v a megadott sebesség;
v in - a legvalószínűbb sebesség.
A Maxwell-féle elosztási törvény Du feltétellel érvényesnek bizonyul Innen megtaláljuk a molekulák azon részét, amelynek relatív sebessége a Du intervallumban van: A számítások elvégzése előtt meg kell győződni arról, hogy a Du feltétel A Du kiszámításához először keressük meg a legvalószínűbb sebességet T=400 K és T=900 K mellett a következő képlet segítségével: v v1 \u003d 2 × 8,31 × 400 / 0,002 \u003d 1,82 × 10 3 m/s, v v2 = 2 × 8,31 × 900 / 0,002 \u003d 2,73 × 10 3 m/s. Ha ezeket a v értékeket behelyettesítjük, és szem előtt tartjuk, hogy Dv=10 m/s, mivel a probléma v v = -5,0 m/s és v v = +5,0 m/s közötti tartományban lévő sebességekkel foglalkozik, a következőt kapjuk: Du 1 \u003d 1/182, Du 2 = 1/273. Mivel u=1, azt látjuk, hogy a Du feltétel
Most keressük meg DN 1 /N=4/((3,14) 1/2×2,7×182)=0,0046, DN 2 /N=4/((3,14) 1/2×2,7×273)=0,0030. Így a hőmérséklet emelkedésével a legvalószínűbb molekulasebesség nő, miközben csökken azoknak a molekuláknak a száma, amelyek sebessége a legvalószínűbb körüli intervallumban van.![]() .
.
![]()