1 oldal
A vegyértékelmélet fontos szerepet játszott általában a kémia elméletének és különösen a szerves kémiának a fejlődésében. Kekulé a vegyértékelméletből kiindulva feltételezte, hogy a szénatom négy vegyértékű, és 1858-ban erre a feltételezésre támaszkodva megpróbálta a legegyszerűbb szerves molekulák és gyökök szerkezetét ábrázolni. Ugyanebben 1858-ban a skót kémikus, Archibald Scott Cooper (1831-1892) azt javasolta, hogy az atomokat összekötő erőket (vagy kötéseket, ahogyan szokták nevezni) kötőjelekkel ábrázolják. Az első szerves molekula „felépítése” után teljesen világossá vált, hogy a szerves molekulák általában miért sokkal nagyobbak és összetettebbek, mint a szervetlenek.
Kekulé elképzelései szerint a szénatomok a négy vegyértékkötés közül egy vagy több segítségével kapcsolódhatnak egymáshoz, és hosszú láncokat alkothatnak - egyenes vagy elágazó láncúak. Úgy tűnik, egyetlen más atom sem rendelkezik ilyen figyelemre méltó képességgel, mint a szén.
Tehát, ha elképzeljük, hogy minden szénatomnak négy vegyértékkötése van, és minden hidrogénatomnak van egy ilyen kötése, akkor ábrázolhatjuk a három legegyszerűbb szénhidrogént (olyan vegyületeket, amelyek molekuláit csak szén- és hidrogénatomok alkotják), a metán CH4, etán C2H6 és propán C3H8. , a következő módon:
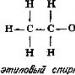
A szénatomok számának növelésével ez a sorozat folytatható, és szinte a végtelenségig. Ha oxigént (két vegyértékkötés) vagy nitrogént (három vegyértékű kötés) adunk a szénhidrogénlánchoz, az etil-alkohol (C2H6O) és a metil-amin (CH5N) molekulák szerkezeti képleteit ábrázolhatjuk: 
Feltételezve két kötés (kettős kötés) vagy három kötés (hármas kötés) lehetőségét a szomszédos atomok között, az olyan vegyületek szerkezeti képlete ábrázolható, mint az etilén (C2H4), acetilén (C2H2), metil-cianid (C2H3N), aceton (C3H6O). ) és ecetsav (C2H4O2): 
A szerkezeti képletek hasznossága annyira nyilvánvaló volt, hogy sok szerves kémikus azonnal átvette azokat. Teljesen elavultnak tartottak minden olyan kísérletet, amely a szerves molekulákat gyökökből épült struktúrákként ábrázolta. Ennek eredményeként szükségesnek tartották egy vegyület képletének felírása során annak atomi szerkezetének bemutatását.
Alekszandr Mihajlovics Butlerov orosz kémikus (1823-1886) ezt az új szerkezeti képletrendszert alkalmazta a szerves vegyületek szerkezetére vonatkozó elméletében. A múlt század 60-as éveiben megmutatta, hogyan lehet szerkezeti képletek segítségével egyértelműen megmagyarázni az izomerek létezésének okait (lásd 5. fejezet). Így például az etil-alkohol és a dimetil-éter C2H6O tapasztalati képlete megegyezik, azonban ezeknek a vegyületeknek a szerkezeti képlete jelentősen eltér: 
ezért nem meglepő, hogy az atomok elrendezésének megváltozása két nagyon eltérő tulajdonságú halmazt eredményez. Az etil-alkoholban minden hatodik hidrogénatom kapcsolódik egy oxigénatomhoz, míg a dimetil-éterben mind a hat hidrogénatom szénatomhoz kapcsolódik. Az oxigénatom gyengébbre tartja a hidrogénatomot, mint a szénatom, így az etil-alkoholhoz adott fém-nátrium helyettesíti a hidrogént (az összes mennyiség egyhatoda). A dimetil-éterhez adott nátrium egyáltalán nem szorítja ki a hidrogént. Így a szerkezeti képletek elkészítésekor a kémiai reakciók vezérelhetők, a szerkezeti képletek pedig segíthetnek megérteni a reakciók lényegét.
Butlerov különös figyelmet szentelt az izoméria egyik típusának, az úgynevezett tautomerizmusnak (dinamikus izoméria), amelyben egyes anyagok mindig két vegyület keverékeként működnek. Ha ezen vegyületek egyikét tiszta formában izoláljuk, az azonnal részben átmegy a másik vegyületbe. Butlerov kimutatta, hogy a tautoméria a hidrogénatom oxigénatomról a szomszédos szénatomra való spontán átalakulásának köszönhető (és fordítva).
A szerkezeti képletek rendszerének érvényességének teljes bizonyításához meg kellett határozni a benzol szerkezeti képletét - egy hat szénatomot és hat hidrogénatomot tartalmazó szénhidrogén. Ez nem történt meg azonnal. Úgy tűnt, hogy nem létezik olyan szerkezeti képlet, amely a vegyérték követelményeinek eleget tenne, ugyanakkor megmagyarázná a vegyület nagyobb stabilitását. A benzol szerkezeti képleteinek első változatai nagyon hasonlóak voltak néhány szénhidrogén képletéhez – olyan vegyületekhez, amelyek nagyon instabilok, és kémiai tulajdonságaikban nem hasonlítanak a benzolhoz.
A szerves kémia a szénatom kémiája. A szerves vegyületek száma több tízszer nagyobb, mint a szervetleneké, ami csak magyarázható a szénatom jellemzői :
a) Benne van az elektronegativitási skála közepe a második periódusban ezért nem kifizetődő számára, hogy feladja a sajátját és elfogadja mások elektronjait, és pozitív vagy negatív töltést szerezzen;
b) az elektronhéj speciális szerkezete - nincsenek elektronpárok és szabad pályák (csak egy hasonló szerkezetű atom van még - hidrogén, valószínűleg ezért hoz létre a szén a hidrogénnel annyi vegyületet - szénhidrogént).
A szénatom elektronszerkezete
С - 1s 2 2s 2 2p 2 vagy 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafikusan:
A gerjesztett állapotban lévő szénatomnak a következő elektronikus képlete van:
* С - 1s 2 2s 1 2p 3 vagy 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Cellákként: 
S- és p-pályák alakja


Atompálya - a tér azon tartománya, ahol a legvalószínűbb az elektron detektálása, a megfelelő kvantumszámokkal.
Ez egy háromdimenziós elektronikus "kontúrtérkép", amelyben a hullámfüggvény határozza meg, hogy a pálya egy adott pontján mekkora a relatív valószínűsége egy elektron megtalálásának.
Az atompályák relatív mérete az energiájuk növekedésével nő ( főkvantumszám- n), alakjukat és térbeli tájolásukat pedig az l és m kvantumszámok határozzák meg. A pályán lévő elektronokat spinkvantumszám jellemzi. Egy pálya legfeljebb 2 elektront tartalmazhat ellentétes spinekkel.
Amikor kötések jönnek létre más atomokkal, a szénatom átalakítja az elektronhéját úgy, hogy a legerősebb kötések jönnek létre, és így a lehető legtöbb energia szabadul fel, és a rendszer a legnagyobb stabilitást kapja.
Az atom elektronhéjának megváltoztatásához energiára van szükség, amit azután erősebb kötések kialakulása kompenzál.
Az elektronhéj átalakulása (hibridizáció) főként 3 típusú lehet, attól függően, hogy a szénatom hány atommal köt kötést.
A hibridizáció típusai:
sp 3 - egy atom kötést létesít 4 szomszédos atommal (tetraéderes hibridizáció):
Az sp 3 elektronikus képlete egy hibrid szénatom:
* С –1s 2 2 (sp 3) 4 cellák formájában 

A hibrid pályák közötti kötési szög ~ 109°.
A szénatom sztereokémiai képlete:

sp 2 - Hibridizáció (valencia állapot)- egy atom kötést létesít 3 szomszédos atommal (trigonális hibridizáció):
Az sp 2 - hibrid szénatom elektronikus képlete:
* С –1s 2 2 (sp 2) 3 2p 1 cellák formájában 
A hibrid pályák közötti kötési szög ~ 120°.
Az sp 2 - hibrid szénatom sztereokémiai képlete:

sp- Hibridizáció (valencia állapot) - egy atom kötést létesít 2 szomszédos atommal (lineáris hibridizáció):
Az sp - hibrid szénatom elektronikus képlete:
* С –1s 2 2 (sp) 2 2p 2 cellák formájában 
A hibrid pályák közötti kötési szög ~ 180°.
Sztereokémiai képlet:

Az s-pálya minden típusú hibridizációban részt vesz, hiszen minimális energiával rendelkezik.
Az elektronfelhő átrendeződése lehetővé teszi a legerősebb kötések kialakulását és az atomok minimális kölcsönhatását a létrejövő molekulában. Ahol a hibrid pályák nem lehetnek azonosak, de a kötési szögek eltérőek lehetnek, például CH 2 Cl 2 és СCl 4
2. Kovalens kötések szénvegyületekben
Kovalens kötések, tulajdonságok, módszerek és oktatási okok - az iskolai tanterv.
Csak hadd emlékeztesselek:
1. Kommunikáció kialakítása Az atomok közötti átfedés az atompályáik átfedésének eredményeként tekinthető, és minél hatékonyabb (minél nagyobb az átfedési integrál), annál erősebb a kötés.
A számított adatok szerint az S rel atompályák relatív átfedési hatásfoka a következőképpen nő:

Következésképpen a hibrid pályák, például az sp 3 -szénpályák alkalmazása négy hidrogénatomos kötések kialakításában erősebb kötések kialakulásához vezet.
2. A szénvegyületekben a kovalens kötések kétféleképpen jönnek létre:
A)Ha két atompálya a főtengelyük mentén átfedi egymást, akkor a létrejövő kötést nevezzük - σ-kötés.
Geometria.Így a metánban a hidrogénatomokkal való kötések kialakulása során a szénatom négy hibrid sp 3 ~ pályája átfedésben van négy hidrogénatom s-pályájával, négy azonos erős σ-kötést képezve, amelyek 109 ° 28 -os szöget zárnak be. egymáshoz (standard tetraéder szög) Hasonló szigorúan szimmetrikus tetraéderes szerkezet jön létre például a CCl 4 képződése során is, ha a szénnel kötést alkotó atomok nem azonosak, pl. CH 2 C1 2 esetén , a térszerkezet kissé el fog térni a teljesen szimmetrikustól, bár lényegében tetraéderes marad ...
Σ-kötés hossza A szénatomok közötti arány az atomok hibridizációjától függ, és csökken, ha sp 3 - hibridizációról sp-re váltunk. Ennek oka az a tény, hogy az s-pálya közelebb van a maghoz, mint a p-pálya, ezért minél nagyobb a töredéke a hibridpályán, annál rövidebb, és ebből következően a létrejövő kötés is rövidebb.
B) Ha két atomos p -az egymással párhuzamos pályák az atomok elhelyezkedésének síkja felett és alatt oldalirányú átfedést hajtanak végre, a létrejövő kötést ún. - π (pi) - kommunikáció


Oldalirányú átfedés Az atomi pályák áramlása kevésbé hatékony, mint a főtengely mentén történő átfedés π -a kapcsolatok kevésbé erősek, mint σ -kapcsolat. Ez különösen abban nyilvánul meg, hogy a szén-szén kettős kötés energiája kevesebb, mint kétszerese az egyszeres kötés energiájának. Így a C-C kötés energiája az etánban 347 kJ/mol, míg a C = C kötés energiája az eténben csak 598 kJ/mol, és nem ~ 700 kJ/mol.
Két atomi 2p pálya oldalirányú átfedésének mértéke , és innen az erő π -kötés maximális, ha két szénatom és négy kapcsolódik hozzájuk az atomok szigorúan egy síkban helyezkednek el, vagyis ha ők egysíkú , mivel csak ebben az esetben az atomi 2p pályák pontosan párhuzamosak egymással, ezért képesek maximális átfedésre. Bármilyen eltérés a koplanáris állapottól a körüli forgás következtében σ - a két szénatomot összekötő kötés az átfedés mértékének csökkenéséhez és ennek megfelelően az erősség csökkenéséhez vezet π -kötés, ami így segít megőrizni a molekula laposságát.
Forgás szén-szén kettős kötés körül lehetetlen.
terjesztés π Az -elektronok a molekula síkja felett és alatt a létezést jelentik negatív töltésű területek készen áll a kölcsönhatásra bármilyen elektronhiányos reagenssel.
Az oxigén, nitrogén stb. atomjai is eltérő vegyértékállapotúak (hibridizációk), míg elektronpárjaik egyaránt lehetnek hibrid és p-pályán.
A szén (C) a periódusos rendszer hatodik eleme, amelynek atomtömege 12. Az elem a nemfémekhez tartozik, izotópja 14 C. A szénatom szerkezete minden szerves kémia alapja, mivel minden szerves anyag tartalmaz szénmolekulák.
szénatom
Szénpozíció Mengyelejev periódusos rendszerében:
- hatodik sorozatszám;
- negyedik csoport;
- második időszakban.

Rizs. 1. A szén helyzete a periódusos rendszerben.
A táblázat adatai alapján megállapíthatjuk, hogy a szén elem atomjának szerkezete két héjat foglal magában, amelyeken hat elektron található. A szerves anyagok részét képező szén vegyértéke állandó és egyenlő a IV. Ez azt jelenti, hogy négy elektron van a külső elektronszinten, kettő pedig a belsőn.
A négy elektron közül kettő egy gömb alakú 2s pályát, a maradék kettő pedig egy 2p súlyzó alakú pályát foglal el. Gerjesztett állapotban a 2s pályáról egy elektron átkerül az egyik 2p pályára. Amikor egy elektron az egyik pályáról a másikra mozog, energia elhasználódik.
Így egy gerjesztett szénatomnak négy párosítatlan elektronja van. Konfigurációja a 2s 1 2p 3 képlettel fejezhető ki. Ez lehetővé teszi négy kovalens kötés kialakítását más elemekkel. Például egy metán (CH 4) molekulában a szén négy hidrogénatommal alkot kötéseket - egy kötés a hidrogén és szén s-pályái között, és három kötés a szén p-pályái és a hidrogén s-pályái között.
A szénatom szerkezetének diagramja + 6C) 2) 4 vagy 1s 2 2s 2 2p 2 alakban ábrázolható.

Rizs. 2. A szénatom szerkezete.
Fizikai tulajdonságok
A szén a természetben kőzetek formájában fordul elő. A szén számos allotróp módosulata ismert:
- grafit;
- gyémánt;
- carbyne;
- szén;
- korom.
Mindezek az anyagok különböznek a kristályrács szerkezetében. A legkeményebb anyag, a gyémánt, köb alakú szén. Magas hőmérsékleten a gyémánt hatszögletű szerkezetű grafittá alakul.

Rizs. 3. Grafit és gyémánt kristályrácsai.
Kémiai tulajdonságok
A szén atomi szerkezete és az a képessége, hogy egy másik anyag négy atomját meg tudja kötni, meghatározza az elem kémiai tulajdonságait. A szén fémekkel reagálva karbidokat képez:
- Ca + 2C → CaC 2;
- Cr + C → CrC;
- 3Fe + C → Fe 3 C.
Reagál fém-oxidokkal is:
- 2ZnO + C → 2Zn + CO 2;
- PbO + C → Pb + CO;
- SnO 2 + 2C → Sn + 2CO.
Magas hőmérsékleten a szén nemfémekkel, különösen hidrogénnel reagál, szénhidrogéneket képezve:
C + 2H 2 → CH 4.
Oxigénnel a szén szén-dioxidot és szén-monoxidot képez:
- C + O 2 → CO 2;
- 2С + О 2 → 2СО.
Vízzel való kölcsönhatás során szén-monoxid is keletkezik.
A legegyszerűbb szerves vegyület a metán. Molekulája öt atomból áll - egy szénatomból és négy hidrogénatomból, amelyek egyenletesen oszlanak el a központi szénatom körül. Itt mindenekelőtt a szerves kémia legfontosabb posztulátumával kell szembenéznünk - minden töltetlen szerves molekulában a szén mindig négyértékű. Grafikailag ez abban fejeződik ki, hogy négy kötőjellel kombinálni kell más elemek vagy ugyanazon szén kémiai szimbólumaival. A metánban mind a négy hidrogénatom azonos távolságra van a szénatomtól, és a lehető legtávolabb egymástól térben.
A metánmolekulában egy szénatom egy szabályos tetraéder közepén, négy hidrogénatom pedig annak csúcsaiban található.
Így néz ki egy metánmolekula az atomok méretét figyelembe véve.
A molekula modelljének felépítéséhez veszünk egy tetraédert, azaz egy szabályos tetraédert, amely egyenlő oldalú háromszögekből áll, és egy szénatomot helyezünk a középpontjába. A hidrogénatomok a tetraéder csúcsai mentén helyezkednek el. Kössük össze az összes hidrogént a központi szénatommal. Két ilyen vonal közötti α szög 109 fok és 28 perc.
Tehát felépítettünk egy metánmodellt. De milyenek a molekulák méretei a valóságban? Az elmúlt évtizedekben fizikai kutatási módszerekkel (erről később lesz szó) lehetőség nyílt a szerves vegyületek molekuláiban az atomközi távolságok pontos meghatározására. Egy metánmolekulában a szénatom és bármely hidrogénatom középpontja közötti távolság 0,109 nm (1 nanométer, nm, 10-9 m). A molekulák térbeli kinézetének megjelenítéséhez a Stewart-Brigleb modelleket használják, amelyekben az atomokat bizonyos sugarú golyókkal ábrázolják.
Most tegyük fel magunknak a következő kérdést: milyen erők kötik meg a szerves vegyület molekulájában az atomokat, miért nem szakadnak el a hidrogénatomok a széncentrumtól?
A szénatom egy pozitív töltésű magból (töltése +6) és hat elektronból áll, amelyek az atommag körül különböző pályákat foglalnak el *, amelyek mindegyike egy bizonyos energiaszintnek felel meg.
* (A pályát a tér azon tartományának tekinthetjük, amelyben a legnagyobb az elektrontal való találkozás valószínűsége.)
Két elektron foglalja el az atommaghoz legközelebbi legalacsonyabb pályát. A legerősebben a "magjukkal" lépnek kölcsönhatásba, és nem vesznek részt a kémiai kötések kialakításában. A másik négy elektron más dolog. Úgy gondolják, hogy az úgynevezett gerjesztetlen szénatomban, vagyis egy különálló atomban, amely nem képez semmilyen kötést más atomokkal, ezek az elektronok a következőképpen helyezkednek el: kettő az alsó alszinten s kettő pedig magasabb alszinten R... Némileg leegyszerűsítve és sematikusan feltételezhetjük, hogy egy elektront alkotó felhő helyezkedik el s-alszint, gömb alakú. Felhők R Az elektronok térfogati nyolcasoknak tűnnek, és ezek a nyolcasok a tengelyek mentén helyezkedhetnek el a térben x, yés z... Ennek megfelelően minden atomnak három van R-pályák: p x, p yés p z. Tehát az atomban minden pályának van egy bizonyos alakja, és különleges módon helyezkedik el a térben.
Ahhoz, hogy kölcsönhatásba léphessen más atomokkal, kémiai kötéseket létesítsen velük, a szénatomnak mindenekelőtt egy speciális, izgatott állapot. Ebben az esetben egy elektron ugrik le s-pályák bekapcsolva p- orbitális. Ennek eredményeként egy elektron egy gömb alakút foglal el s-pálya, a másik három elektron pedig három nyolcas pályát alkot. Ez a helyzet azonban energetikailag hátrányos az atom számára. Az atom alacsonyabb energiája négy azonos, a térben szimmetrikusan elhelyezkedő pályának felel meg. Ezért van keverés, átlagolás, vagy ahogy mondják, hibridizáció elérhető pályák, és az eredmény négy új azonos pálya.
Ezek a hibrid pályák is hasonlóak a nyolcasokhoz, de a nyolcasok egyoldalúak: az elektronsűrűség szinte teljesen eltolódik az egyik oldalra. Az ilyen hibridizált pályákat jelöljük sp 3(a kialakulásukban részt vevő különböző nem-hibrid pályák elektronjainak száma szerint: egy s-pályák és három - -val R-orbitális).
Hogyan működik a metán molekula? Mind a négy hibrid pályára, amelyek a szénatomtól különböző irányokba irányulnak (vagy inkább egy képzeletbeli tetraéder sarkaiba, amely köré építhető), a hidrogénatomok alkalmasak H. A hidrogénatom egy olyan mag, amelynek töltése kb. +1 (a közönséges hidrogén könnyű izotópjához - csak egy proton), és egy elektron a proton körül gömbpályát foglal el. A „szén” és „hidrogén” elektronok felhői átfedik egymást, és ez kémiai kötés kialakulását jelenti. Minél jobban fedik egymást a különböző atomokból álló elektronfelhők, annál erősebb a kötés. Most már világossá válik, hogy a hibridizált pályák miért jövedelmezőbbek – elvégre egy ilyen egyoldalú, domború nyolcas alak sokkal erősebben átfedhet a hidrogén elektronfelhővel, mint a nem hibrid pályák, amelyek kevésbé terjednek ki az űrben. Vegyük észre, hogy ez az érvelés némileg önkényes: tiszta, úgymond egyetlen és gerjesztetlen szénatom valójában nem létezik. Ezért nincs értelme annak megvitatása, hogy mindezek az orbitális átalakulások, amelyeket hibridizációnak neveznek, valójában hogyan történik. A kémiai kötések képletek és számok segítségével történő leírásának megkönnyítésére azonban az ilyen konvenciók hasznosak. Erről többször is meg fogunk győződni.
Hogyan lehet metánhoz jutni?
Az egyik legegyszerűbb módszer az alumínium-karbid vízzel való feldolgozása:
Az alumínium-karbid azonban túl drága alapanyag egy ilyen közönséges, olyan olcsó termék, mint a metán előállításához, és nem kell más vegyületekből előállítani – a földgáz ugyanis 85-98%-ban metánból áll.
A metán az egyik fő építőelem, amelyből szerves vegyületeket lehet építeni. Mik ezek a vegyületek, és hogyan nyerhetők ki metánból?
Valójában a metán egy viszonylag inert anyag, és a vele végrehajtható kémiai reakciók halmaza kicsi.
Vegyünk két gáz – metán és klór – keverékét, és tegyük egy üvegedénybe. Ha ezt az edényt sötétben tartják, akkor nem figyelhető meg reakció. De próbáljuk meg napfénnyel megvilágítani az üveget..
A fénykvantum kölcsönhatásba lép egy klórmolekulával, ennek eredményeként a molekula két részre - két klóratomra - szakad:
![]()
Az így létrejövő atomok sokkal aktívabbak, mint a molekulák, azonnal megtámadják a metánmolekulákat és befogják a hidrogénatomokat. Ebben az esetben hidrogén-klorid HCl molekulák és nagyon instabil, nagyon aktív részecskék, az úgynevezett metil-gyökök ⋅CH 3 keletkeznek:
Az eredmény egy általunk már ismert klóratom (a jövőbeli sorsát nem nehéz megjósolni: új metánmolekulákat támad meg, és minden megismétlődik), a klór-metán, vagyis a metil-klorid pedig a metán származéka, amelyben az egyik hidrogén atomokat klór helyettesíti.
Az általunk leírt reakció az ún láncreakciók, amelyben az egyes szakaszok, mint egy láncban, összekapcsolódnak az előzővel és a következővel. Az aktív részecskéket - az egyik szakasz termékét (itt ezek a klóratomok és a ⋅СН 3 metilcsoportok) - a következő szakaszban kiindulási anyagként használják. A láncreakciók felfedezése a kémiai tudomány történetének egyik fő eseménye volt, és N. N. Semenov akadémikus és S. N. Khishelwood angol tudós Nobel-díjat kapott az ilyen reakciók tanulmányozásában és elméletük megalkotásában nyújtott hozzájárulásukért.
Ha olyan mennyiségű reagenst viszünk be a reakcióba, hogy egy klórmolekulán két metánmolekula legyen, akkor alapvetően CH 3 Cl metil-kloridot kapunk. Ha feleslegben veszünk fel klórt, akkor a szubsztitúciós reakció tovább megy, és a metil-kloridon kívül metilén-klorid CH 2 Cl 2, kloroform CHCl 3 és végül a hidrogén klórral való teljes helyettesítésének termékét, szenet kapunk. tetraklorid CCl 4:
De ne feledkezzünk meg feladatunkról sem: egyszerű metán építőelemekből különféle összetett molekulákat építeni. Ehhez metil-kloridra van szükségünk. Ha erre a vegyületre fémes nátriummal hat, akkor minden két CH 3 Cl molekulából egy etán molekula keletkezik, amelyben szén-szén kötés van:
Mi az az etán? Ez a metán, amelyben az egyik hidrogént a metil-⋅CH 3 gyök helyettesíti. És magát ezt a gyököt, mint már tudjuk, egy hidrogénatom metántól való elválasztásával kapjuk.
Ha most az etánban az egyik hidrogént (bármely atomot) metilre cseréljük, akkor új anyagot kapunk - propán CH 3 -CH 2 -CH 3. Hogy ez a gyakorlatban hogyan valósítható meg, azt tudjuk: először metánban és etánban cseréljünk ki egy hidrogént klórra, majd metil- és etil-klorid-nátrium keverékére (ezt a reakciót Würz-reakciónak nevezik a francia kémikus tiszteletére, felfedezte):
Menjünk tovább. Cseréljük ki az egyik hidrogénatomot klórral a propánban. Kiderült, hogy most már mindegy, melyik atomot cseréljük le! Ha a hidrogént a szélső szénatomon (két ilyen atom van) vagy átlagosan helyettesítve, két különböző vegyületet kapunk: normál propil-kloridot ( n-propil-klorid) és izopropil-klorid:

Helyettesítsük most ezekben a vegyületekben a klóratomokat metilcsoportokkal. Két különböző butánt kapunk - normál (azaz nem elágazó) butánt ( n-bután) és iso-bután:


Adjunk hozzá még egy "téglát" a kapott molekulákhoz. Kezdjük azzal n-bután. Itt helyettesítheti a metilt az egyik szélsőséges hidrogénatommal. Normál pentánt kapunk. Cserélheti az egyik közepes hidrogént. Gyerünk iso-pentán. Nyilván attól n-bután már nem kapsz semmi újat. Térjünk rá iso-bután. Ha az egyik szélső hidrogént (CH 3 -csoportokban) helyettesítjük benne, akkor a már említetthez jutunk. iso-pentán, és a középső egyetlen hidrogénatomot helyettesítve neopentánt kapunk:

Ezt az eljárást korlátlanul folytathatja. Mindezeket a kapcsolatokat ún szénhidrogének(pontosabban - telített, telített szénhidrogének vagy alkánok), mert csak két elemből állnak - szénből és hidrogénből. Bármely alkánban a hidrogénatomok száma 2 n+ 2, hol n- a szénatomok száma. Ezért a korlátozó szénhidrogén képlete általános formában a következőképpen írható fel: C n N 2n + 2 .
Szerkezeteink építésekor, azt kell mondanom, időben megálltunk. Az a tény, hogy a lehetséges izomerek száma katasztrofálisan gyorsan növekszik az alkánmolekulában lévő szénatomok számának növekedésével. Tehát a dekán esetében egy С 10 Н 22 szénhidrogén, esetleg 75 különböző izomer, a С 20 Н 42 szénhidrogén (eikozán) izomereinek száma 366 319. A tetrakontán, egy С 420 szénhidrogén lehetséges izomereinek száma 820 Н nehéz elképzelni: 62 491 178 805 831.
Most már világossá válik, hogy miért ismert már ma ilyen hatalmas számú szerves vegyület - több millió -, és ebből a szempontból a szerves kémia miért előzte meg messze a szervetlen kémiát. De eddig csak a szerves anyagok legegyszerűbb képviselőiről beszéltek - a telített szénhidrogénekről.
Számos izomer szénhidrogént állítottunk elő metánból a Wurtz-reakció segítségével. A gyakorlatban azonban ezt senki nem teszi meg. A helyzet az, hogy a legegyszerűbb szénhidrogéneket a metánnal együtt a földgáz tartalmazza, amelynek összetétele a különböző mezőkben eltérő. Például a Severo-Stavropol mezőről származó gáz 85% metánt, körülbelül 5% etánt, 2,5% propánt és 1,4% pentánt és nehezebb szénhidrogéneket tartalmaz. A Gazlinskoye mező gáza 98%-ban metánból áll, a benne lévő etán csak 1,6%. Sok szénhidrogén van az olajban, de erről a következő fejezetekben bővebben.
Az alacsonyabb szénhidrogének - metán, etán, propán és bután - színtelen, szagtalan vagy enyhe benzinszagú gázok. A szénhidrogének a pentántól a C 15 H 32 pentadekánig folyékonyak, és végül a magasabb szénhidrogének normál hőmérsékleten szilárd anyagok.

A szénatomok számának növekedésével a vegyület forráspontja és olvadáspontja növekszik.
A telített szénhidrogéneknek más neve is van - paraffinok tükrözi kémiai tehetetlenségüket (latin parum affinis- alacsony affinitás). És mégis széles körben használják a vegyiparban sokféle anyag előállítására. A metán ipari felhasználásának főbb irányait az ábra mutatja.
Mielőtt befejeznénk a metánról és a telített szénhidrogénekről szóló beszélgetést, válaszoljunk egy kérdésre: hogyan történik a kötés a paraffinokban két szénatom között, például az etánban? Itt minden egyszerű - minden szénatom körül, mint a metánban, négy hibridizálódik sp 3 -pálya, közülük három hidrogénatommal létesít kötést, az egyik pedig egy másik szénatom pontosan ugyanazon pályájával fedi át. A C-C kötés hossza 0,154 nm.
A szénatom az alapvető építőelem, amelyből a szerves vegyületek épülnek. Ahhoz, hogy a vegyértékhéjat nyolc elektronnal töltse meg (mint egy inert gáz), egy szénatomnak párosítania kell elektronjait négy hidrogénatom elektronjaival.
Az elektronok hibridizációja és párosítása következtében mind a szén vegyértékelektronhéja, mind a hidrogénatomok vegyértékhéja megtelik. Rendkívül stabil elektronikus konfiguráció jön létre, és egy stabil CH 4 molekula, a metán keletkezik.
A különböző atomok elektronjai párokat alkotnak, amelyeket szimbolikusan pontok jelölnek. Minden ilyen elektronpár kovalens kötést ad. A kényelem kedvéért a különböző atomokból származó elektronpárok mindegyikét vagy kovalens kötést általában vonalként (kötésként) ábrázolják, amely összekapcsolt atomokat köt össze.

A szénatom négy kötése azt a négy vegyértéket jelenti, amellyel a szénatom rendelkezik. Hasonlóképpen, az egyes hidrogénatomok és egy szénatom között egy kötés egy vegyértéket jelent, amellyel mindegyik hidrogénatom rendelkezik.
Ezek az egyszerűsített ábrázolások azonban nem tükrözik a metánmolekula valódi 3D geometriáját. A metán a hibridizáció miatt tetraéderes szerkezetű. A metánban lévő НСН kötések közötti összes szög 109,5 ° (8. ábra). A tetraéderes szerkezet lehetővé teszi, hogy a hidrogénatomok mindegyike a szomszédos hidrogénatomoktól a legtávolabbi helyet foglalja el. Ennek eredményeként a szomszédos hidrogénatomok közötti taszító erők minimálisak.

A metán szén-hidrogén kovalens kötései erős kötések. 1 g molekula (1 mol) metán (16 g) szén- és hidrogénatomjának kinyeréséhez 404 kcal energiára lenne szükség. Mivel a metánmolekulában négy szén-hidrogén kötés van, mindegyik átlagos energiája 101 kcal/mol. Az ilyen kötést nagyon erős kovalens kötésnek tekintik.