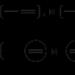MEGHATÁROZÁS
Nátrium-hidroxid kemény fehér, nagyon higroszkópos kristályokat képez, amelyek 322 o C-on olvadnak.
A szövetekre, bőrre, papírra és egyéb szerves anyagokra kifejtett erős maró hatása miatt marószódának nevezik. A mérnöki gyakorlatban a nátrium-hidroxidot gyakran nátronlúgnak nevezik.
A vízben a nátrium-hidroxid nagy mennyiségű hő felszabadulásával oldódik fel a hidrátok képződése miatt.
A nátrium-hidroxidot jól zárható edényekben kell tárolni, mivel könnyen felszívja a levegőből a szén-dioxidot, fokozatosan nátrium-karbonáttá alakul.
Rizs. 1. Nátrium-hidroxid. Kinézet.
Nátrium-hidroxid kinyerése
A nátrium-hidroxid előállításának fő módja a nátrium-klorid vizes oldatának elektrolízise. Az elektrolízis során a hidrogénionok kisülnek a katódon, ezzel egyidejűleg a katód közelében nátriumionok és hidroxidionok halmozódnak fel, azaz. nátrium-hidroxidot kapunk; klór szabadul fel az anódon.
2NaCl + 2H 2O = H 2 + Cl 2 + 2NaOH.
A nátrium-hidroxid előállítására szolgáló elektrolitikus módszer mellett néha még mindig a régebbi módszert alkalmazzák - szódaoldat forralását oltott mésszel:
A nátrium-hidroxid kémiai tulajdonságai
A nátrium-hidroxid savakkal reagálva sókat és vizet képez (semlegesítési reakció):
NaOH + HCl = NaCl + H 2 O;
2NaOH + H 2 SO 4 = Na 2 SO 4 + H 2 O.
A nátrium-hidroxid oldat megváltoztatja az indikátorok színét, így például ha ennek a lúgnak az oldatához lakmuszt, fenolftaleint vagy metilnarancsot adunk, színük kékre, málnás színűre, sárgára változik.
A nátrium-hidroxid sóoldatokkal (ha azok oldhatatlan bázist képezni képes fémet tartalmaznak) és savas oxidokkal reagál:
Fe 2 (SO 4) 3 + 6NaOH = 2Fe (OH) 3 ↓ + 3Na 2 SO 4;
2NaOH + CO 2 = Na 2 CO 3 + H 2 O.
Nátrium-hidroxid alkalmazása
A nátrium-hidroxid a fő vegyipar egyik legfontosabb terméke. Nagy mennyiségben fogyasztják kőolajtermékek tisztítására; A nátrium-hidroxidot széles körben használják a szappan-, papír-, textiliparban és más iparágakban, valamint a mesterséges szálak gyártásában.
Példák problémamegoldásra
1. PÉLDA
| Gyakorlat | Számítsa ki a nátrium-hidroxid tömegét, amely reagálhat 300 ml-es tömény sósavoldattal (a HCl tömeghányada 34%, sűrűsége 1,168 kg / l). |
| Megoldás | Írjuk fel a reakcióegyenletet: NaOH + HCl = NaCl + H 2 O. Határozza meg a sósavoldat tömegét, valamint a benne lévő oldott sósav tömegét: m oldat = V oldat × ρ; m oldat = 0,3 × 1,168 = 0,3504 kg = 350,4 g. ω = m oldott anyag / m oldat × 100%; m oldott anyag = ω / 100% × m oldat; m oldott anyag (HCl) = ω (HCl) / 100% × m oldat; m oldott anyag (HCl) = 34/100% × 350,4 = 11,91 g. Számítsuk ki a sósav mol mennyiségét (móltömeg 36,5 g / mol): n (HCl) = m (HCl) / M (HCl); n (HCl) = 11,91/36,5 = 0,34 mol. Az n (HCl) reakcióegyenlet szerint n (NaOH) = 1:1. n (NaOH) = n (HCl) = 0,34 mol. Ekkor a reagált nátrium-hidroxid tömege egyenlő lesz (móltömeg - 40 g / mol): m (NaOH) = n (NaOH) x M (NaOH); m (NaOH) = 0,34 × 40 = 13,6 g. |
| Válasz | A nátrium-hidroxid tömege 13,6 g. |
2. PÉLDA
| Gyakorlat | Számítsuk ki a nátrium-karbonát tömegét, amely szükséges ahhoz, hogy nátrium-hidroxidot kapjunk 3,5 g tömegű kalcium-hidroxiddal reagáltatva. |
| Megoldás | Írjuk fel a nátrium-karbonát és a kalcium-hidroxid közötti kölcsönhatás és a nátrium-hidroxid képződésének reakciójának egyenletét: Na 2 CO 3 + Ca (OH) 2 = CaCO 3 ↓ + 2NaOH. Számítsuk ki a kalcium-hidroxid anyag mennyiségét (móltömeg - 74 g / mol): n (Ca (OH) 2) = m (Ca (OH) 2) / M (Ca (OH) 2); n (Ca(OH)2) = 3,5/74 = 0,05 mol. Az n (Ca (OH) 2) reakcióegyenlet szerint: n (Na 2 CO 3) = 1:1. Ekkor a nátrium-karbonát móljainak száma egyenlő lesz: n (Na 2CO 3) = n (Ca (OH) 2) = 0,05 mol. Keresse meg a nátrium-karbonát tömegét (móltömeg - 106 g / mol): m (Na 2CO 3) = n (Na 2CO 3) × M (Na 2CO 3); m (Na 2CO 3) = 0,05 × 106 = 5,3 g. |
| Válasz | A nátrium-karbonát tömege 5,3 g. |
· A nátrium-hidroxiddal való biztonságos kezelésre irányuló óvintézkedések · Irodalom és middot
A nátrium-hidroxid iparilag kémiai és elektrokémiai módszerekkel állítható elő.
Kémiai módszerek nátrium-hidroxid előállítására
A nátrium-hidroxid előállításának kémiai módszerei közé tartozik a mész és a ferrit.
A nátrium-hidroxid előállításának kémiai módszereinek jelentős hátrányai vannak: sok energiahordozót fogyasztanak el, a keletkező marószóda erősen szennyezett szennyeződésekkel.
Ma ezeket a módszereket szinte teljesen felváltják az elektrokémiai gyártási módszerek.
Mész módszer
A nátrium-hidroxid előállításának mészmódszere a szódaoldat és az oltott més kölcsönhatásából áll, körülbelül 80 ° C-on. Ezt a folyamatot kausztifikációnak nevezik; a reakción megy keresztül:
Na 2 CO 3 + Ca (OH) 2 = 2NaOH + CaCO 3
A reakció során nátrium-hidroxid oldat és kalcium-karbonát csapadék képződik. A kalcium-karbonátot elválasztják az oldattól, majd bepárolják, így olvadt terméket kapnak, amely a tömeg körülbelül 92%-át tartalmazza. NaOH. Miután a NaOH-t megolvasztják és vashordókba öntik, ahol megszilárdul.
Ferrites módszer
A nátrium-hidroxid előállítására szolgáló ferrites módszer két lépésből áll:
- Na 2 CO 3 + Fe 2 O 3 = 2NaFeO 2 + CO 2
- 2NaFeО 2 + xH 2 О = 2NaOH + Fe 2 O 3 * xH 2 О
Az 1. reakció a szóda szinterezésének folyamata vas-oxiddal 1100-1200 °C hőmérsékleten. Ezenkívül egy folt képződik - nátrium-ferrit és szén-dioxid szabadul fel. Ezután a pogácsát vízzel kezeljük (kioldjuk) a 2. reakció szerint; nátrium-hidroxid oldatot és Fe 2 O 3 * xH 2 O csapadékot kapunk, amelyet az oldattól való elválasztás után visszavezetünk a folyamatba. A kapott lúgos oldat körülbelül 400 g/l NaOH-t tartalmaz. Bepároljuk, így a tömeg körülbelül 92%-át tartalmazó terméket kapunk. NaOH-t, majd szilárd terméket kapunk granulátum vagy pehely formájában.
Elektrokémiai módszerek nátrium-hidroxid előállítására
Elektrokémiai úton nátrium-hidroxidot kapunk halit oldatok elektrolízise(főleg nátrium-kloridból álló ásvány) hidrogén és klór egyidejű termelésével. Ez a folyamat a következő összefoglaló képlettel ábrázolható:
2NaCl + 2H 2 О ± 2е - → H 2 + Cl 2 + 2NaOHA maró lúgot és a klórt három elektrokémiai módszerrel állítják elő. Közülük kettő szilárd katódos elektrolízis (membrános és membrános módszerek), a harmadik folyékony higanykatódos elektrolízis (higanyos módszer).
A világ ipari gyakorlatában a klór és a lúg előállításának mindhárom módszerét alkalmazzák, nyilvánvaló tendenciával a membránelektrolízis arányának növelésére.
Oroszországban az összes előállított marónátron körülbelül 35%-át higanykatódos elektrolízissel, 65%-át pedig szilárd katódos elektrolízissel állítják elő.
Membrán módszer
Egy régi membrános elektrolizáló rajza klór és lúg előállítására: A- anód, V- szigetelők, VAL VEL- katód, D- gázokkal töltött tér (az anód felett - klór, a katód felett - hidrogén), M- rekeszizom
Az elektrokémiai eljárások közül a legegyszerűbb az elektrolizátor folyamatának és szerkezeti anyagainak megszervezése szempontjából a nátrium-hidroxid előállítására szolgáló membrános módszer.
A membrános elektrolizátorban lévő sóoldat folyamatosan az anódtérbe kerül, és rendszerint az acél katódhálóra felvitt azbeszt membránon folyik keresztül, amelybe bizonyos esetekben kis mennyiségű polimer szálat adnak.
Az elektrolizátorok számos kivitelében a katód teljesen bemerül az anolitréteg alá (elektrolit az anódtérből), és a katódracsra felszabaduló hidrogént gázkivezető csövek segítségével távolítják el a katód alól anélkül, hogy a membránon keresztül behatolna az ellenáramlás miatti anódtér.
Az ellenáramlás nagyon fontos jellemzője a membrános elektrolizátor kialakításának. Az anódtérből a porózus membránon keresztül a katódtérbe irányított ellenáramnak köszönhetően lehetővé válik a lúg és a klór külön kinyerése. Az ellenáramú áramlást úgy tervezték, hogy megakadályozza az OH - ionok diffúzióját és migrációját az anódtérbe. Ha az ellenáramlás mértéke nem elegendő, akkor az anódtérben nagy mennyiségben hipoklorit ion (ClO -) kezd képződni, amely ezt követően az anódnál oxidálható ClO 3 - klorátionná. A klorát ion képződése jelentősen csökkenti a klór fluxus hatékonyságát, és a nátrium-hidroxid előállításának ezen eljárásának egyik fő mellékterméke. Az oxigén felszabadulása is káros, ami ráadásul az anódok tönkremeneteléhez, illetve ha szénanyagból készül, foszgén szennyeződések bejutásához vezet a klórba.
Anód: 2Cl - 2е → Cl 2 - fő folyamat 2H 2O-2e- → O 2 + 4H+ Katód: 2H 2O + 2e → H2 + 2OH - fő folyamat СlО - + Н 2 О + 2е - → Сl - + 2ОН - СlО 3 - + 3Н 2 O + 6е - → Сl - + 6OH -
A membránelektrolizátorok anódjaként grafit- vagy szénelektródák használhatók. Manapság ezeket főként ruténium-titán-oxid bevonatú titán anódokra (ORTA anódokra) vagy más alacsony fogyasztású anódokra váltották fel.
A következő lépésben az elektrolitikus lúgot elpárologtatják, és a benne lévő NaOH-tartalmat a tömeg 42-50%-ára állítják be. szabványnak megfelelően.
A só, nátrium-szulfát és egyéb szennyeződések, ha koncentrációjuk az oldatban az oldhatósági határ fölé emelkedik, kicsapódnak. A maró lúgos oldatot dekantáljuk az üledékről, és késztermékként raktárba szállítjuk, vagy a bepárlási lépést folytatjuk, hogy szilárd terméket kapjunk, majd megolvasztjuk, pelyhesítjük vagy granuláljuk.
A reverset, vagyis az üledékben kristályosodott konyhasót visszavezetik a folyamatba, elkészítve belőle az úgynevezett fordított sóoldatot. A szennyeződések oldatokban való felhalmozódásának elkerülése érdekében a visszatérő sóoldat elkészítése előtt a szennyeződéseket elválasztják.
Az anolitveszteséget a sórétegek földalatti kilúgozásával nyert friss sóoldat, ásványi sóoldat, például bischofit hozzáadásával pótolják, amelyet előzőleg szennyeződésektől megtisztítottak vagy halitet oldottak. A friss sóoldatot a fordított sóoldattal való keverés előtt megtisztítják a mechanikai szuszpenzióktól és a kalcium- és magnéziumionok jelentős részétől.
A keletkező klórt elválasztják a vízgőztől, összenyomják és klórtartalmú termékek előállításához vagy cseppfolyósításhoz vezetik.
Viszonylagos egyszerűsége és alacsony költsége miatt a nátrium-hidroxid előállítására szolgáló membrános eljárást még mindig széles körben használják az iparban.
Membrán módszer
A nátrium-hidroxid előállítására szolgáló membrán módszer a legenergiahatékonyabb, ugyanakkor nehéz megszervezni és működtetni.
Az elektrokémiai folyamatok szempontjából a membránmódszer hasonló a membrános módszerhez, de az anód- és katódteret teljesen elválasztja egy anionok számára át nem eresztő kationcserélő membrán. Ennek a tulajdonságnak köszönhetően lehetővé válik több tiszta folyadék előállítása, mint a membrános módszer esetében. Ezért a membránelektrolizátorban, a membránnal ellentétben, nem egy áram van, hanem kettő.
A membrános módszerhez hasonlóan sóoldat áramlik be az anódtérbe. És a katódon - ionmentesített víz. A katódtérből kimerült anolit áramlik ki, amely hipoklorit és klorát ionokat és klórt is tartalmaz, az anódtérből pedig lúg és hidrogén, gyakorlatilag szennyeződésmentes és a kereskedelmi koncentrációhoz közel, ami csökkenti az energiafogyasztást. elpárologtatásukra és tisztításukra.
A membránelektrolízissel nyert lúg minőségében gyakorlatilag nem rosszabb, mint a higanykatódos módszerrel kapott lúg, és lassan helyettesíti a higanymódszerrel kapott lúgot.
Ezzel egyidejűleg az etetősóoldatot (friss és keringő) és a vizet előzetesen a lehető legjobban megtisztítják az esetleges szennyeződésektől. Ezt az alapos tisztítást a polimer kationcserélő membránok magas költsége és a betáplált oldatban lévő szennyeződésekkel szembeni érzékenysége határozza meg.
Ezenkívül az ioncserélő membránok korlátozott geometriai alakja, valamint ezen túlmenően alacsony mechanikai szilárdsága és hőstabilitása nagyrészt meghatározza a membránelektrolízis üzemek viszonylag összetett felépítését. Ugyanezen okból a membránüzemek a legkifinomultabb automatikus felügyeleti és vezérlőrendszereket igényelnek.
Membrán elektrolizáló diagram.Higany folyékony katód módszer
A lúg előállításának elektrokémiai módszerei közül a leghatékonyabb módszer a higanykatódos elektrolízis. A folyékony higanykatóddal elektrolízissel nyert lúgok sokkal tisztábbak, mint a membrános módszerrel nyert lúgok (egyes iparágakban ez kritikus). Például mesterséges szálak előállításához csak nagy tisztaságú lúg használható), és a membránmódszerhez képest a lúg higanymódszerrel történő előállítási folyamatának megszervezése sokkal egyszerűbb.
Higanycella diagram.A higanyelektrolízis berendezés egy elektrolizátorból, egy amalgámbontóból és egy higanyszivattyúból áll, amelyek higanyvezető kommunikációval vannak összekötve.
Az elektrolizátor katódja egy szivattyú által szivattyúzott higanyáram. Anódok - grafit, szén vagy alacsony kopás (ORTA, TDMA vagy mások). A higannyal együtt a nátrium-klorid betáplált árama folyamatosan áramlik át az elektrolizátoron.
Az anódon az elektrolitból klórionok oxidálódnak, és klór szabadul fel:
2Cl - 2е → Cl 2 0 - fő folyamat 2H 2O-2e- → O 2 + 4H+ 6СlО - + 3Н 2 О - 6е - → 2СlО 3 - + 4Сl - + 1,5O 2 + 6Н +A klórt és az anolitot eltávolítják az elektrolizátorból. Az elektrolizálóból kilépő anolitot friss halittal telítik, a vele bevitt szennyeződéseket eltávolítják, majd az anódokból és szerkezeti anyagokból kimossák, és visszavezetik az elektrolízisbe. További telítés előtt a benne oldott klórt kivonják az anolitból.
A katódon a nátriumionok redukálódnak, amelyek gyenge nátrium-oldatot képeznek higanyban (nátrium-amalgám):
Na + + e = Na 0 nNa + + nHg = Na + HgAz amalgám folyamatosan áramlik az elektrolizátorból az amalgámbontóba. A lebontót is folyamatosan ellátják nagy tisztaságú vízzel. Ebben a nátrium-amalgám egy spontán kémiai folyamat eredményeként víz hatására szinte teljesen lebomlik, higany, maróoldat és hidrogén képződésével:
Na + Hg + H 2 O = NaOH + 1 / 2H 2 + HgAz így kapott maró oldat, amely kereskedelmi termék, gyakorlatilag nem tartalmaz szennyeződéseket. A higanyt szinte teljesen megszabadítják a nátriumtól, és visszakerül az elektrolizálóba. A hidrogént tisztítás céljából eltávolítjuk.
A lúgoldat teljes tisztítása a higanymaradványoktól azonban gyakorlatilag lehetetlen, ezért ez a módszer fémhigany és gőzei szivárgásával jár.
A termelés környezetbiztonságával szembeni növekvő követelmények és a fémhigany magas költsége a higanyos módszer fokozatos kiszorulásához vezet a szilárd katódos lúggyártás módszereivel, különösen a membrános módszerrel.
Megszerzésének laboratóriumi módszerei
A laboratóriumban néha kémiai módszerekkel állítják elő a nátrium-hidroxidot, de gyakrabban kis membrános vagy membrán típusú elektrolizátort használnak.
Bevezetés .
A nátrium-hidroxidot vagy nátronlúgot (NaOH), a klórt, a sósavat, a hidrogén-kloridot és a hidrogént jelenleg iparilag nátrium-klorid oldat elektrolízisével állítják elő.
A nátronlúg vagy nátrium-hidroxid egy erős lúg, a mindennapi életben nátronlúgnak nevezik, szappangyártásban, alumínium-oxid gyártásban - fémalumínium előállításának köztes terméke, festék- és lakkiparban, olajfinomító iparban használják. , a műselyem gyártásában, a szerves szintézis iparban és más nemzetgazdasági ágazatokban.
Klórral, hidrogén-kloriddal, sósavval és nátronlúggal végzett munka során szigorúan be kell tartani a biztonsági szabályokat: a klór belélegzése éles köhögést és fulladást, a légutak nyálkahártyájának gyulladását, tüdőödémát, majd később kialakulást okoz. gyulladásos gócok kialakulása a tüdőben.
Még ha a levegőben elhanyagolható mennyiségben is, a hidrogén-klorid irritációt okoz az orrban és a torokban, bizsergést a mellkasban, rekedtséget és fulladást okoz. Kis koncentrációjú krónikus mérgezés esetén a fogak különösen érintettek, amelyek zománca gyorsan elpusztul.
A sósavmérgezés nagyon hasonló Val vel klór mérgezés.
A nátrium-hidroxid előállításának kémiai módszerei.
A nátrium-hidroxid előállításának kémiai módszerei közé tartozik a mész és a ferrit.
A nátrium-hidroxid előállításának meszes módszere szódaoldat és mésztej kölcsönhatásából áll, körülbelül 80 ° C hőmérsékleten. Ezt a folyamatot kausztifikációnak nevezik; azt a reakció írja le
Na 2 C0 3 + Ca (OH) 2 = 2NaOH + CaC0 3 (1)
oldatos üledék
Az (1) reakció szerint nátrium-hidroxid oldatot és kalcium-karbonát csapadékot kapunk. A kalcium-karbonátot elválasztják az oldattól, majd bepárolják körülbelül 92% NaOH-ot tartalmazó olvadt termékké. Az olvadt NaOH-t vashordókba öntik, ahol megszilárdul.
A ferrites módszert két reakció írja le:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (2)
nátrium-ferrit
Na 2 0 Fe 2 0 3 -f H 2 0 = 2 NaOH + Fe 2 O 3 (3)
oldatos üledék
A (2) reakció a szóda vas-oxiddal történő szinterezésének folyamatát mutatja be 1100-1200 °C hőmérsékleten. Ebben az esetben szinter-nátrium-ferrit képződik, és szén-dioxid szabadul fel. Ezután a pogácsát vízzel kezeljük (kioldjuk) a (3) reakció szerint; nátrium-hidroxid oldatot és Fe 2 O 3 csapadékot kapunk, amelyet az oldattól való elválasztás után visszavezetünk a folyamatba. Az oldat körülbelül 400 g/l NaOH-t tartalmaz. Bepároljuk, így körülbelül 92% NaOH-ot tartalmazó terméket kapunk.
A nátrium-hidroxid előállításának kémiai módszereinek jelentős hátrányai vannak: nagy mennyiségű üzemanyagot használnak fel, a keletkező marónátron szennyeződésekkel szennyeződik, a berendezés karbantartása fáradságos stb. Jelenleg ezeket a módszereket szinte teljesen felváltja az elektrokémiai gyártási módszer .
Az elektrolízis és az elektrokémiai folyamatok fogalma.
Az elektrokémiai folyamatok olyan kémiai folyamatok, amelyek vizes oldatokban vagy állandó elektromos áram hatására megolvadnak.
Az oldatok és olvadt sók, savak és lúgok oldatai, az úgynevezett elektrolitok a második típusú vezetőkre utalnak, amelyekben az elektromos áram átvitelét ionok végzik. (Az első típusú vezetőknél, például fémeknél, az áramot elektronok viszik.) Amikor elektromos áram áthalad egy elektroliton, az elektródákon ionok kisülése következik be, és a megfelelő anyagok felszabadulnak. Ezt a folyamatot elektrolízisnek nevezik. Az elektrolízist végző berendezést elektrolizátornak vagy elektrolitfürdőnek nevezik.
Az elektrolízist számos vegyi termék - klór, hidrogén, oxigén, lúgok stb. - előállítására használják. Meg kell jegyezni, hogy elektrolízissel nagy tisztaságú vegyi termékeket állítanak elő, amelyek bizonyos esetekben kémiai előállítási módszerekkel nem érhetők el.
Az elektrokémiai eljárások hátrányai közé tartozik az elektrolízis során fellépő nagy energiafogyasztás, ami növeli a keletkező termékek költségét. E tekintetben az elektrokémiai folyamatokat csak olcsó villamos energia alapján célszerű elvégezni.
Nyersanyagok nátrium-hidroxid előállításához.
A nátrium-hidroxid, klór, hidrogén előállításához konyhasó oldatot használnak, amelyet elektrolízisnek vetnek alá.Az konyhasó a természetben földalatti kősólerakódások formájában, tavak és tengerek vizében, valamint természetes sóoldatok vagy oldatok formájában. A kősó lelőhelyek a Donbassban, az Urálban, Szibériában, Transkaukáziában és más régiókban találhatók. Hazánkban egyes tavak sóban is gazdagok.
Nyáron a tavak felszínéről elpárolog a víz, és a konyhasó kristályok formájában kihullik. Ezt a sót önülepedőnek nevezik. A tengervíz legfeljebb 35 g/l nátrium-kloridot tartalmaz. Meleg éghajlatú helyeken, ahol intenzív vízpárolgás történik, tömény nátrium-klorid oldatok keletkeznek, amelyekből kikristályosodik. A föld belsejében, sórétegekben felszín alatti vizek áramlanak, amelyek feloldják a NaCl-t és földalatti sóoldatot képeznek, amelyek fúrásokon keresztül jutnak ki a felszínre.
A sóoldatok, függetlenül az előállítás módjától, kalcium- és magnézium-sók szennyeződéseit tartalmazzák, és mielőtt az elektrolízis osztályba kerülnének, megtisztítják ezeket a sókat. A tisztításra azért van szükség, mert az elektrolízis során rosszul oldódó kalcium- és magnézium-hidroxidok képződhetnek, amelyek megzavarják az elektrolízis normál lefolyását.
A sóoldatot szóda és mésztej oldatával megtisztítják. A vegyszeres tisztításon túl az oldatokat ülepítéssel és szűréssel mentesítik a mechanikai szennyeződésektől.
A nátrium-klorid oldatok elektrolízise szilárd vas (acél) katóddal és membránnal ellátott fürdőben, valamint folyékony higanykatódos fürdőben történik. Mindenesetre a modern, nagy klórműhelyek berendezésére használt ipari elektrolizátoroknak nagy termelékenységűeknek, egyszerű kialakításúnak, kompaktnak, megbízhatóan és stabilan kell működniük.
Nátrium-klorid oldatok elektrolízise fürdőben acélkatóddal és grafit anóddal .
Lehetővé teszi nátrium-hidroxid, klór és hidrogén előállítását egy berendezésben (elektrolizátorban). Amikor egyenáram áramlik át nátrium-klorid vizes oldatán, klórfejlődés várható:
2CI -- 2eÞ C1 2 (a)
valamint oxigén:
20Н - - 2eÞ 1 / 2О 2 + Н 2 О (b)
H20-2eÞ1/2О2 + 2H+
Az OH - - ionok kisülésének normál elektródpotenciálja + 0,41 v, a klórionok kisülésének normál elektródpotenciálja pedig + 1.36 v. Semleges, telített nátrium-klorid-oldatban a hidroxil-ionok koncentrációja körülbelül 1 · 10-7 g-eq/l. 25 ° C-on a hidroxil-ionok kisülésének egyensúlyi potenciálja lesz
A kisülés egyensúlyi potenciálja, klórionok NaCl koncentrációnál 4,6 oldatban g-eq/l egyenlő
Következésképpen az oxigént először az alacsony túlfeszültségű anódon kell levezetni.
A grafitos anódokon azonban az oxigén túlfeszültség jóval nagyobb, mint a klór túlfeszültsége, ezért elsősorban C1 ionokat bocsátanak ki - az (a) reakció szerint gáznemű klór felszabadulásával.
A klór felszabadulását elősegíti az oldat NaCl koncentrációjának növekedése az egyensúlyi potenciál értékének csökkenése miatt. Ez az egyik oka a 310-315 tartalmú tömény nátrium-klorid oldatok elektrolízisének. g/l.
A lúgos oldatban lévő katódon vízmolekulák kisülése történik az egyenlet szerint
H 2 0 + e = H + OH - (c)
A hidrogénatomok a rekombináció után molekuláris hidrogén formájában szabadulnak fel
2H Þ H 2 (g)
A nátriumionok vizes oldatokból történő kisülése szilárd katódon lehetetlen, mivel kisülésük potenciálja nagyobb a hidrogénhez képest. Ezért az oldatban maradó hidroxidionok nátriumionokkal lúgos oldatot képeznek.
A NaCI bomlási folyamata a következő reakciókkal fejezhető ki:
azaz az anódon klór, a katódon pedig hidrogén és nátrium-hidroxid képződik.
Az elektrolízis során a leírt főbb folyamatokkal együtt mellékfolyamatok is előfordulhatnak, amelyek közül az egyiket a (b) egyenlet írja le. Ezenkívül az anódon felszabaduló klór részben feloldódik az elektrolitban és a reakciónak megfelelően hidrolizál
Lúgok (OH-ionok) anódra történő diffúziója vagy katódos és anódtermékek kiszorítása esetén a hipoklór- és sósavakat lúggal semlegesítik, így hipokloritot és nátrium-kloridot képeznek:
HOC1 + NaOH = NaOCl + H 2 0
HC1 + NaOH = NaCl + H 2 0
Az anódnál lévő ClO - ionok könnyen ClO 3 - oxidálódnak. Következésképpen az elektrolízis során fellépő mellékfolyamatok következtében hipoklorit, nátrium-klorid és klorát képződik, ami az áram- és energiahatékonyság csökkenéséhez vezet. Lúgos környezetben elősegíti az oxigén felszabadulását az anódon, ami az elektrolízis teljesítményét is rontja.
A mellékreakciók előfordulásának csökkentése érdekében olyan feltételeket kell teremteni, amelyek megakadályozzák a katód és az anód termékek keveredését. Ezek közé tartozik a katód- és anódterek membránnal történő elválasztása, valamint az elektrolit szűrése a membránon az OH-ionok anód felé irányuló mozgásával ellentétes irányban. Az ilyen membránokat szűrőmembránoknak nevezik, és azbesztből készülnek.
Bevezetés
Egy üzletbe érkezett, hogy illatmentes szappant vásároljon. Természetesen annak megértéséhez, hogy ebből a választékból mely termékeknek van szaga és melyeknek nem, minden egyes üveg szappant a kezébe vesz, és elolvassa az összetételét és tulajdonságait. Végül a megfelelőt választottuk, de a szappanok különféle formáit nézegetve furcsa tendenciát vettünk észre - szinte minden palackon ez állt: "A szappan szerkezete nátrium-hidroxidot tartalmaz." Ez a standard történet, amelyet a legtöbb ember ismer a nátrium-hidroxiddal kapcsolatban. Az emberek néhány fele "kiköp és elfelejt", és néhányan többet akarnak tudni róla. Nekik ma elmondom, milyen anyagról van szó.
Meghatározás
A nátrium-hidroxid (NaOH képlet) a világon a leggyakoribb lúg. Referenciaként: a lúg vízben jól oldódó bázis.
Név
Különböző forrásokban nátrium-hidroxidnak, nátronlúgnak, marónátronnak, nátronlúgnak vagy lúgnak nevezhető. Bár a "maró lúg" elnevezés az ebbe a csoportba tartozó összes anyagra alkalmazható. Csak a 18. században kaptak külön nevet. A most leírt anyagnak van egy "fordított" neve is - nátrium-hidroxid, amelyet általában az ukrán fordításokban használnak.

Tulajdonságok
Mint mondtam, a nátrium-hidroxid nagyon jól oldódik vízben. Ha egy kis darabot is beleteszel egy pohár vízbe, néhány másodperc múlva meggyullad, és sziszegve „rohan” és „ugrál” a felületén (fotó). És ez addig fog folytatódni, amíg teljesen fel nem oldódik benne. Ha a reakció befejeződése után leengedi a kezét a kapott oldatba, akkor az tapintásra szappanos lesz. Ahhoz, hogy megtudja, milyen erős egy lúg, indikátorokat merítenek bele - fenolftaleint vagy metilnarancsot. A fenolftalein bíborvörös, a metilnarancs pedig sárgává válik. A nátrium-hidroxidban, mint minden lúgban, hidroxidionok vannak jelen. Minél több van belőlük az oldatban, annál világosabbak az indikátorok, és annál erősebb a lúg.
Fogadás
A nátrium-hidroxid előállításának két módja van: kémiai és elektrokémiai. Nézzük meg mindegyiket közelebbről.

Alkalmazás
A cellulóz delignifikációja, a karton, a papír, a farostlemez és a műszálak előállítása nem teljes nátrium-hidroxid nélkül. És amikor reakcióba lép a zsírokkal, szappant, sampont és egyéb mosószereket kapnak. A kémiában számos reakcióban reagensként vagy katalizátorként használják. A nátrium-hidroxid E524 élelmiszer-adalékanyagként is ismert. És ez nem minden alkalmazási ág.
Következtetés
Most már mindent tud a nátrium-hidroxidról. Mint látható, ez nagy előnyökkel jár az ember számára - mind az iparban, mind a mindennapi életben.
A nátrium-hidroxid előállításának kémiai módszerei közé tartozik a mész és a ferrit.
A nátrium-hidroxid előállításának kémiai módszereinek jelentős hátrányai vannak: sok energiahordozót fogyasztanak el, a keletkező marószóda erősen szennyezett szennyeződésekkel.
Ma ezeket a módszereket szinte teljesen felváltják az elektrokémiai gyártási módszerek.
Mész módszer
A nátrium-hidroxid előállításának mészmódszere a szódaoldat és az oltott més kölcsönhatásából áll, körülbelül 80 ° C-on. Ezt a folyamatot kausztifikációnak nevezik; a reakción megy keresztül:
Na 2 CO 3 + Ca (OH) 2 = 2NaOH + CaCO 3
A reakció során nátrium-hidroxid oldat és kalcium-karbonát csapadék képződik. A kalcium-karbonátot elválasztják az oldattól, majd bepárolják, így olvadt terméket kapnak, amely a tömeg körülbelül 92%-át tartalmazza. NaOH. Miután a NaOH-t megolvasztják és vashordókba öntik, ahol megszilárdul.
Ferrites módszer
A nátrium-hidroxid előállítására szolgáló ferrites módszer két lépésből áll:
Na 2 CO 3 + Fe 2 O 3 = 2NaFeО 2 + CO 2
2NaFeО 2 + xH 2 О = 2NaOH + Fe 2 O 3 *xH 2 O
Az 1. reakció a szóda szinterezésének folyamata vas-oxiddal 1100-1200 °C hőmérsékleten. Ezenkívül egy folt képződik - nátrium-ferrit és szén-dioxid szabadul fel. Ezután a pogácsát vízzel kezeljük (kioldjuk) a 2. reakció szerint; nátrium-hidroxid oldatot és Fe 2 O 3 * xH 2 O csapadékot kapunk, amelyet az oldattól való elválasztás után visszavezetünk a folyamatba. A kapott lúgos oldat körülbelül 400 g/l NaOH-t tartalmaz. Bepároljuk, így a tömeg körülbelül 92%-át tartalmazó terméket kapunk. NaOH-t, majd szilárd terméket kapunk granulátum vagy pehely formájában.
Elektrokémiai módszerek nátrium-hidroxid előállítására
Elektrokémiai úton nátrium-hidroxidot kapunk halit oldatok elektrolízise(főleg nátrium-kloridból álló ásvány) hidrogén-klorid egyidejű előállításával. Ez a folyamat a következő összefoglaló képlettel ábrázolható:
2 NaCl + 2H 2 O ± 2e - → H 2 + Cl 2 + 2 NaOH
A maró lúgot és a klórt három elektrokémiai módszerrel állítják elő. Közülük kettő szilárd katódos elektrolízis (membrános és membrános módszerek), a harmadik folyékony higanykatódos elektrolízis (higanyos módszer).
A világ ipari gyakorlatában a klór és a lúg előállításának mindhárom módszerét alkalmazzák, nyilvánvaló tendenciával a membránelektrolízis arányának növelésére.
7. Kén-dioxid tisztítása katalitikus mérgektől.
A gáznemű kibocsátások ezen ipari vállalkozások telephelyein igen kedvezőtlenül befolyásolják a környezeti helyzetet, valamint rontják az egészségügyi és higiéniai munkakörülményeket. Az agresszív tömegkibocsátások közé tartoznak a nitrogén-oxidok, a hidrogén-szulfid, a kén-dioxid, a szén-dioxid és sok más gáz.
Például hazánkban a salétromsav, a kénsav és más gyárak évente több tízmillió köbméter nitrogén-oxidot bocsátanak ki a légkörbe, amely erős és veszélyes méreg. Ezekből a nitrogén-oxidokból több ezer tonna salétromsavat lehetne előállítani.
Ugyanilyen fontos feladat a gázok kén-dioxidból történő tisztítása. A kén teljes mennyisége, amely hazánkban csak kén-dioxid formájában kerül a légkörbe, körülbelül 16 millió tonna . évben. Ebből a kénmennyiségből akár 40 millió tonna kénsavat is elő lehet állítani.
Jelentős mennyiségű ként, főként hidrogén-szulfid formájában, a kokszolókemence-gáz tartalmaz.
A gyárkéményekből és erőművekből származó füstgázok évente több milliárd köbméter szén-dioxidot bocsátanak ki a légkörbe. Ez a gáz hatékony széntartalmú műtrágyák előállítására használható.
A fenti példák megmutatják, milyen hatalmas anyagi értékek kerülnek a légkörbe gáznemű kibocsátással.
De ezek a kibocsátások súlyosabb károkat okoznak abban, hogy a városokban és a vállalkozásoknál mérgezik a légmedencét: a mérgező gázok elpusztítják a növényzetet, rendkívül károsak az emberek és állatok egészségére, tönkreteszik a fémszerkezeteket, korrodálják a berendezéseket.
Bár az elmúlt években a hazai ipari vállalkozások nem működtek teljes kapacitással, a káros kibocsátás elleni küzdelem nagyon akut problémát jelent. És tekintettel a bolygó általános ökológiai helyzetére, a legsürgősebb és legradikálisabb intézkedéseket kell megtenni a kipufogógázok káros szennyeződésektől való megtisztítására.
Katalitikus mérgek
kontaktmérgek, olyan anyagok, amelyek a katalizátorok "mérgezését" okozzák (lásd. Katalizátorok) (általában heterogének), azaz csökkentik katalitikus aktivitásukat vagy teljesen leállítják katalitikus hatásukat. A heterogén katalizátorok mérgezése a méregnek vagy annak kémiai átalakulásának termékének a katalizátor felületén történő adszorpciója következtében következik be. A mérgezés lehet visszafordítható vagy visszafordíthatatlan. Így a vaskatalizátoron végbemenő ammóniaszintézis reakciójában az oxigén és vegyületei reverzibilisen mérgezik a Fe-t; ebben az esetben tiszta N 2 + H 2 keveréknek kitéve a katalizátor felülete oxigéntől mentesül, és a mérgezés csökken. A kénvegyületek visszafordíthatatlanul mérgezik a Fe-t, a tiszta keverék hatása nem tudja visszaállítani a katalizátor aktivitását. A mérgezés elkerülése érdekében a katalizátorba juttatott reakcióelegyet alaposan megtisztítják. A leggyakoribb To. I. fémkatalizátorokhoz oxigént (H 2 O, CO, CO 2), ként (H 2 S, CS 2, C 2 H 2 SH stb.), Se, Te, N, P, As, Sb, as anyagokat tartalmazó anyagok valamint a telítetlen szénhidrogének (C 2 H 4, C 2 H 2) és fémionok (Cu 2+, Sn 2+, Hg 2+, Fe 2+, Co 2+, Ni 2+). A savas katalizátorokat általában bázikus szennyeződésekkel mérgezik, a bázikusakat pedig savas szennyeződésekkel.
8. Nitrózus gázok kinyerése.
A fehérítés után felszabaduló nitrogén-oxidokat vízben és sóoldatban kondenzálják, és nyers keverék előállítására használják fel. Mivel az N 2 O 4 forráspontja 20,6 °C 0,1 MPa nyomáson, ilyen körülmények között a gáznemű NO 2 teljesen kondenzálható (az N 2 O 4 telített gőznyomása 21,5 °C-on folyékony N 2 O 4 felett egyenlő 0,098 MPa, azaz kisebb, mint a légköri). A folyékony nitrogén-oxidok előállításának másik módja az, hogy nyomás alatt és csökkentett hőmérsékleten kondenzálják őket. Ha felidézzük, hogy az NH 3 légköri nyomáson történő kontaktoxidációja során a nitrogén-oxidok koncentrációja nem haladja meg a 11 térfogatszázalékot, a parciális nyomásuk 83,5 Hgmm-nek felel meg. A nitrogén-oxidok nyomása a folyadék felett (gőznyomás) a kondenzációs hőmérsékleten (–10 °C) 152 Hgmm. Ez azt jelenti, hogy a kondenzációs nyomás növelése nélkül ezekből a gázokból nem nyerhetők folyékony nitrogén-oxidok, ezért a nitrogén-oxidok kondenzációja egy ilyen nitrogéntartalmú gázból –10 °C hőmérsékleten 0,327 MPa nyomáson kezdődik. A kondenzáció mértéke meredeken növekszik, ha a nyomás 1,96 MPa-ra emelkedik; további nyomásnövekedéssel a kondenzáció mértéke jelentéktelenül változik.
A nitrogéngáz feldolgozása (azaz az NH 3 átalakítása után) folyékony nitrogén-oxiddá nem hatékony, mert még P = 2,94 MPa mellett is 68,3% a kondenzáció mértéke.
A tiszta N 2 O 4 kondenzációs körülményei között a hűtést nem szabad -10 °C alatt végezni, mert –10,8 °C-on N 2 O 4 kristályosodik. A NO, NO 2, H 2 O szennyeződések jelenléte csökkenti a kristályosodási hőmérsékletet. Így az N 2 O 4 + 5% N 2 O 3 összetételű keverék –15,8 ° C-on kristályosodik.
A keletkező folyékony nitrogén-oxidokat acéltartályokban tárolják.
9. Egyszerű és kettős szuperfoszfát előállítása
A "szuperfoszfát" Ca (H 2 PO 4) 2 * H 2 O és CaSO 4 keveréke. A leggyakoribb egyszerű ásványi foszfor műtrágya. A szuperfoszfátban lévő foszfor főként monokalcium-foszfát és szabad foszforsav formájában van jelen. A műtrágya gipszet és egyéb szennyeződéseket (vas- és alumínium-foszfát, szilícium-dioxid, fluorvegyületek stb.) tartalmaz. A foszforitokból egyszerű szuperfoszfátot kapnak kénsavval kezelve, a következő reakció szerint:
kb 3 (RO 4 ) 2 + 2H 2 ÍGY 4 = kb(H 2 PO 4 ) 2 + 2CaSO 4 .
Egyszerű szuperfoszfát- szürke por, szinte nem csomósodik, közepesen diszpergálható; műtrágyában 14-19,5% a növények által asszimilált P 2 O 5. Az egyszerű szuperfoszfát előállításának lényege a természetes, vízben és talajoldatokban nem oldódó fluorapatit átalakítása oldható vegyületekké, elsősorban monokalcium-foszfát Ca (H 2 PO 4) 2-vé. A bomlási folyamat a következő összegző egyenlettel ábrázolható:
2Ca5F(PO4)3+7H2SO4+3H2O=3Ca(H2PO4)2*H20]+7+2HF; (1) ΔН = -227,4 kJ.
A gyakorlatban az egyszerű szuperfoszfát előállítása során a bomlás két szakaszban megy végbe. Az első szakaszban az apatit körülbelül 70%-a reagál a kénsavval. Így foszforsav és kalcium-szulfát-hemihidrát keletkezik:
Ca 5F (PO 4) 3 + 5H 2 SO 4 + 2,5 H 2 O = 5 (CaSO 4 * 0,5 H 2 O) + 3H3PO 4 + HF (2)
Az egyszerű szuperfoszfát előállításának funkcionális diagramja az ábrán látható. A fő folyamatok az első három szakaszban zajlanak: a nyersanyagok keverése, a szuperfoszfátpép képzése és megszilárdulása, a szuperfoszfát érlelése a raktárban.

Rizs. Egyszerű szuperfoszfát előállításának funkcionális diagramja
A jobb minőségű piacképes termék előállításához a szuperfoszfátot az érés után szilárd adalékanyagokkal (mészkő, foszfátkőzet stb.) semlegesítik és granulálják.
Dupla szuperfoszfát- koncentrált foszfor műtrágya. A fő foszfortartalmú komponens a kalcium-dihidrogén-ortofoszfát-monohidrát Ca (H 2 PO 4) 2 H 2 O. Általában egyéb kalcium- és magnézium-foszfátokat is tartalmaz. Az egyszerű foszfáthoz képest nem tartalmaz ballasztot - CaSO 4. A kettős szuperfoszfát fő előnye a kis mennyiségű ballaszt, azaz csökkenti a szállítási, tárolási, csomagolási költségeket.
Kettős szuperfoszfát keletkezik a kénsav H 2 SO 4 természetes foszfátokra gyakorolt hatására. Oroszországban elsősorban az áramlásos módszert alkalmazzák: a nyersanyagok lebontását, majd a kapott pép granulálását és szárítását dobgranulátor-szárítóban. A felületről származó, kereskedelemben kapható kettős szuperfoszfátot krétával vagy NH 3-mal semlegesítik, így standard terméket kapnak. Bizonyos mennyiségű kettős szuperfoszfátot kamrás módszerrel állítanak elő. A foszfortartalmú komponensek alapvetően megegyeznek az egyszerű szuperfoszfátéval, de nagyobb mennyiségben, a CaSO 4 tartalom pedig 3-5%. 135-140 °C fölé hevítve a kettős szuperfoszfát bomlásnak indul és a kristályos vízben megolvad, lehűlés után porózussá és törékennyé válik. 280-320 °C-on az ortofoszfátok meta-, piro- és polifoszfátokká alakulnak, amelyek asszimilálható és részben vízoldható formában vannak. 980 °C-on megolvad, lehűlés után üveges termékké alakul, amelyben a metafoszfátok 60-70%-a citrátban oldódik. A kettős szuperfoszfát 43-49% asszimilálható foszforsav-anhidridet (foszfor-pentoxidot) tartalmaz Р 2 О 5 (37-43% vízben oldódó), 3,5-6,5% szabad foszforsavat Н 3 РО 4 (2,5-4,6%) :
Ca 3 (PO 4) 2 + 2H 2 SO 4 = Ca (H 2 PO 4) 2 + 2CaSO 4
Létezik egy módszer a foszfortartalmú nyersanyagok foszforsavval történő lebontására is:
Ca 5 (PO 4) 3 F + 7H 3 PO 4 = 5 Ca (H 2 PO 4) 2 + HF
A kettős szuperfoszfát előállításának technológiai folyamatának blokkvázlata: 1 - zúzott foszfor és foszforsav keverése; 2 - az I. stádiumú foszforit bomlása; 3 - a II. stádiumú foszforit bomlása; 4 - a pép granulálása; 5 - foszfortartalmú gázok tisztítása a portól; 6 - cellulóz granulátum szárítása; 7 - füstgázok fogadása (a kemencében); 8 - száraz termék szűrése; 9 - durva frakció őrlése; 10 - kis és közepes (értékesíthető) frakciók szétválasztása a második szitán; 11 - zúzott durva frakció és finom keverése; 12 - a maradék foszforsav ammonizálása (semlegesítése); 13 - ammóniát és port tartalmazó gázok tisztítása; 14 - a kettős szuperfoszfát semlegesített kereskedelmi frakciójának hűtése;

10. Extrakciós ortofoszforsav előállítása
Extrakciós foszforsav kinyerése
Közvetlenül az EPA beérkezése előtt a foszfort speciális technológiával nyerik

1. ábra A foszfortermelés sémája: 1 - alapanyag tárolóedények; 2 - keverő; 3 - gyűrűs adagoló; 4 - töltőbunker; 5 - elektromos kemence; 6 - salakos merőkanál; 7 - merőkanál ferrofoszforhoz; 8 - elektrosztatikus leválasztó; 5 - kondenzátor; 10 - folyékony foszfor gyűjtése; 11 - olajteknő
Az extrakciós módszer (lehetővé teszi a legtisztább foszforsav előállítását) magában foglalja a fő szakaszokat: az elemi foszfor elégetése (oxidációja) a levegőfeleslegben, a keletkező P4O10 hidratálása és abszorpciója, a foszforsav kondenzációja és a köd felfogása a gázfázisból. A P4O10 előállításának két módja van: a P-gőz oxidációja (az iparban ritkán használatos) és a folyékony P cseppek vagy film formájában történő oxidációja. A P oxidációs állapotát ipari körülmények között az oxidációs zóna hőmérséklete, a komponensek diffúziója és egyéb tényezők határozzák meg. A termikus foszforsav előállításának második szakasza - a P4O10 hidratálása - savval (vízzel) történő abszorpcióval vagy a P4O10 gőzeinek vízgőzzel való kölcsönhatásával történik. A hidratálás (P4O10 + 6H2O4H3PO4) a polifoszforsavak képződésének szakaszain keresztül megy végbe. A keletkező termékek összetétele és koncentrációja a vízgőz hőmérsékletétől és parciális nyomásától függ.
A folyamat minden szakaszát egy berendezésben egyesítik, kivéve a ködgyűjtést, amelyet mindig külön készülékben hajtanak végre. Az iparban általában két vagy három alapkészülékből álló áramköröket használnak. A gázhűtés elvétől függően a termikus foszforsav előállításának három módja van: párolgásos, cirkulációs párologtatásos, hőcserélős bepárlásos.
A víz vagy híg foszforsav elpárologtatásával történő hőelvonáson alapuló párologtató rendszerek a legegyszerűbbek a hardver kialakításában. A füstgázok viszonylag nagy mennyisége miatt azonban az ilyen rendszerek alkalmazása csak kis egységkapacitású létesítményekben javasolt.
A keringtető-párologtató rendszerek lehetővé teszik a P égés, a gázfázis keringető savval történő hűtése és a P4O10 hidratálása egy berendezésben történő kombinálását. Ennek a rendszernek a hátránya, hogy nagy mennyiségű savat kell lehűteni. A hőcserélő és párologtató rendszerek a hőelvonás két módját egyesítik: az égető- és hűtőtornyok falán keresztül, valamint a víz gázfázisból történő elpárologtatásával; a rendszer jelentős előnye a szivattyú- és hűtőberendezéssel ellátott savkeringtető hurkok hiánya.
A hazai vállalkozások cirkulációs-evaporatív hűtési módszerrel (kéttornyos rendszer) technológiai sémákat működtetnek. A rendszer megkülönböztető jellemzői: egy további torony jelenléte a gázhűtéshez, hatékony lemezes hőcserélők használata a keringtető körökben; nagy teljesítményű fúvóka alkalmazása P elégetésére, amely biztosítja a P folyékony sugár homogén, finoman eloszlatott porlasztását és teljes égését kisebb oxidok képződése nélkül.
Az évi 60 ezer tonna 100%-os H3PO4 kapacitású létesítmény technológiai sémája az ábrán látható. 2. Az olvadt sárga foszfort legfeljebb 700 kPa nyomású felmelegített levegővel permetezzük az égetőtoronyban lévő fúvókán keresztül, és keringtető savval permetezzük. A toronyban felmelegített savat lemezes hőcserélőkben keringető víz hűti. A 73-75% H3PO4 tartalmú termelősavat a keringtető körből a raktárba eltávolítják. Ezenkívül az égetőtoronyból származó gázok hűtése és a sav felszívása a hűtő (hidratáló) toronyban történik, ami csökkenti az utószületést, az elektrosztatikus leválasztó hőmérsékleti terhelését és elősegíti a hatékony gáztisztítást. A hőelvonás a hidratáló toronyban 50%-os H3PO4 lemezes hőcserélőkben hűtött keringetésével történik. A hidratáló toronyból a lemezes elektrosztatikus leválasztóban lévő H3PO4 ködből való tisztítás után a gázok a légkörbe kerülnek. 1 tonna 100%-os H3PO4-hoz 320 kg P. fogy.

Rizs. 2. Keringető kéttornyos séma extrakciós H3PO4 előállítására: 1 - savanyúvíz gyűjtő; 2 - foszfortárolás; 3,9 - cirkulációs kollektorok; 4.10 - búvárszivattyúk; 5.11 - lemezes hőcserélők; 6 - égetőtorony; 7 - foszfor fúvóka; 8 - hidratáló torony; 12 - elektrosztatikus leválasztó; 13 - ventilátor.
11. Katalizátorok kén-dioxid kénsav-anhidriddé oxidálásához. Kapcsolatfelvétel
A kénsav-anhidridet a kén-dioxid légköri oxigénnel történő oxidációjával állítják elő:
2SO2 + O2 ↔ 2SO3,
Ez egy visszafordítható reakció.
Régóta megfigyelték, hogy a vas-oxid, a vanádium-pentoxid és különösen a finomra zúzott platina felgyorsítja a kén-dioxid oxidációs reakcióját kénsav-anhidriddé. Ezek az anyagok a kén-dioxid oxidációjának katalizátorai. Így például 400 ° C-on platinizált azbeszt (vagyis azbeszt, amelynek felületére finomra zúzott platina van felhordva) jelenlétében a kén-dioxid majdnem 100% -át a légköri oxigén oxidálja kénsav-anhidriddé. Magasabb hőmérsékleten a kénsav-anhidrid hozama csökken, mivel a fordított reakció felgyorsul - a kénsav-anhidrid kén-dioxiddá és oxigénné bomlásának reakciója. 1000 °C-on a kénsav-anhidrid szinte teljesen lebomlik a kiindulási anyagokra. Így a kénsav-anhidrid szintézisének végrehajtásának fő feltételei a katalizátorok használata és egy bizonyos, nem túl magas hőmérsékletre való melegítés.
A kénsav-anhidrid szintéziséhez további két feltétel betartása is szükséges: a kén-dioxidot meg kell tisztítani a katalizátorok működését gátló szennyeződésektől; A kén-dioxidot és a levegőt szárítani kell, mivel a nedvesség csökkenti a kénsav-anhidrid hozamát.